Электрические свойства коллоидных растворов
В 1909 г.проф. Московского университета Ф.Рейсе наблюдал воздействиепостоянного электрического тока на диспергированную в воде глинуи на этом основании описал электрические свойства коллоидных растворов. Частицы дисперсной фазы (глины) перемещались к аноду, где вследствие их большого скопления наблюдалось помутнение раствора. Частицы же дисперсионной среды (воды) перемещались к катоду, где наблюдалось повышение уровня прозрачной жидкости. Направленное движение частиц к электродам говорило об их заряде, причем стало ясным, что дисперсная фаза несет на себе заряд, противоположный по знаку заряду среды. Движение частиц дисперснойфазы к одному из электродов при пропускании через золь постоянного электрического тока получило название электрофореза, адвижение частиц дисперсионной среды -электроосмос.
Итак, электрофорез и электроосмос обусловлены наличием разноименного заряда у частиц дисперсной фазы и дисперсионной среды. На границе раздела фаз возникает двойной электрический слой, состоящий из тонкой (адсорбционной) части и протяженной диффузной части. Между фазами возникает разность потенциалов, называемая электротермодинамическим потенциалом. Часть скачка потенциала, обусловленная диффузным слоем, называется электрокинетическим потенциалом. Электрокинетический потенциал определяется толщиной и зарядом диффузного слоя, которые зависят от концентрации и заряда противоионов и температуры. Его значение можно регулировать, например, введением противоионов с высоким значением зарядов.
6 Кинетическая и агрегативная устойчивость коллоидных систем
Кинетические свойства коллоидных растворов определяют их кинетическую устойчивость, которая состоит в том, что концентрация коллоидных растворов одинакова по всему объему системы и при правильном хранении не изменяется во времени.
Электрические свойства коллоидных растворов объясняют их агрегативную устойчивость, которая проявляется в том, что частицы дисперсной фазы в коллоидном растворе не укрупняются, не слипаются. Сохранение коллоидной степени дисперсности во времени обусловлено прежде всего наличием одноименного электрического заряда частиц дисперсной фазы, вызывающего их взаимное отталкивание. С увеличением электрокинетического потенциала растет устойчивость коллоидных систем.
Наличие электрического заряда у частиц дисперсной фазы приводит к их значительной гидратации (полярные молекулы воды определенным образом ориентируются относительно заряженных частиц и вступают с ними во взаимодействие). Гидратная оболочка заметно снижает поверхностную энергию дисперсной фазы и тем самым уменьшает стремление частиц к укрупнению. Гидратная оболочка приводит также к разобщению частиц в коллоидном растворе, что повышает агрегативную устойчивость, а иногда даже обеспечивает сохранение коллоидной степени дисперсности.
Частицы дисперсной фазы некоторых веществ, склонных к образованию золей, проявляют большое сродство к молекулам среды, адсорбируя их в первую очередь. Ядро коллоидной частицы таких золей имеет собственную гидратную оболочку. Формула мицеллы золя:

Такие коллоидные растворы называют гидрофильными. Гидрофильные коллоидные растворы приближаются по свойствам к истинным растворам. Это, как правило, золи органического происхождения. Коллоидные растворы большинства неорганических веществ имеют гидрофобный характер.
Агрегативная устойчивость гидрофильных золей особенно велика, так как при наличии защитного действия одноименного заряда коллоидных частиц и общей гидратной оболочки ядра добавляется еще защитное действие гидратной оболочки ядра /Н2О.
Гели и твердые коллоиды.
При длительном хранении гидрофильные золи переходят в особое "студнеобразное" коллоидное состояние. В таком виде их называют гелями. Структура геля такова, что мицеллы не разрушаются, а просто связываются друг с другом, образуя своеобразные ячейки, внутри которых сохраняется среда Н20. Гель можно высушить, превратив его в твердый коллоид (рис. 8.10).
Примером гидрофильного золя может служить золь желатина. В продаже имеется твердый коллоид желатина. При набухании в воде образуется гель. При нагревании геля («студня») образуется золь. Все процессы обратимы:
 Золь Гель Твердый коллоид
Золь Гель Твердый коллоид
Сохранение во всех состояниях мицеллярной структуры связано свысокой устойчивостью гидрофильной коллоидной системы.
Коагуляцияколлоидных растворов
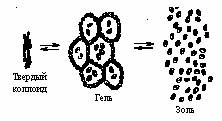
Рисунок 12.2 – Коагуляция коллоидных растворов
Устойчивость золя можно нарушить, устранив одноименный заряд коллоидных частиц и защитную гидратную оболочку. На границе раздела коллоидная частица- среда устанавливаются два равновесия:
Противоины в коллоидной частице  Противоины в среде (а)
Противоины в среде (а)
Вода в коллоидной частице  Вода в среде (б)
Вода в среде (б)
Если сместить равновесие (а) влево, то возрастет число противоионов в коллоидной частице и уменьшится ее заряд. Уменьшение заряда частицы приведет, в свою очередь, к уменьшению числа молекул воды в гидратной оболочке коллоидной частицы, т.е. к смещению равновесия (б) в правую сторону. Устойчивость коллоидной системы нарушится. При некоторых условиях число противоионов в коллоидной частице может стать таким, что их заряд полностью нейтрализует заряд зарядообразующих ионов, т. е. коллоидная частица станет незаряженной. При этом ^-потенциал становится равным нулю. Такое состояние коллоидной частицы называется изоэлектрическим. Гидратная оболочка частицы в изоэлектрическом состоянии в значительной мере разрушена. Коллоидные частицы не защищены и при столкновениях слипаются, укрупняются. Процесс укрупнения частиц, потеря агрегативно устойчивости золя называется коагуляцией. Коагуляция золя приводит к потере его кинетической устойчивости, которая выражается в образовании осадка.
Одним из основных методов коагуляции служит введение в коллоидную систему электролита, имеющего противоионы по отношению к заряженным коллоидным частицам. Например, в растворе с отрицательно заряженными коллоидными частицами вводят сульфаты алюминия или железа. В результате заряд коллоидных частиц нейтрализуется. Кроме того, при этом происходит гидратация ионов электролита за счет молекул Н2О из дисперсионной среды. Эффективность коагуляции возрастает при введении флокулянтов, например полиакриламидов, способствующих укрупнению частиц. Коагуляцию также проводят путем анодного растворения алюминия и железа с переходом в раствор ионов А13+ иFe2+.
ЛЕКЦИЯ № 8
Дата добавления: 2016-11-26; просмотров: 4812;











