Сорбционные процессы
Процесс поглощения одного вещества поверхностью или объемом другого называется сорбцией.
Вещество, частицы которого поглощаются (газ, жидкость или растворенный компонент), называют сорбатом, а поглотитель (чаще твердое тело) – сорбентом.
Сорбционные процессы играют большую роль в технике. Например, для поддержания высокого вакуума в действующем электровакуумном приборе применяют геттеры – специально изготовленные материалы, которые активно поглощают остаточные газы. В качестве геттеров используют компактные (Zr, Ta, Nb и др.) или распыленные (Ba, Ca, Sr ) металлы. Сорбционные процессы широко используют в металлургии при обогащении руд (флотация), в энергетике при водоподготовке (ионный обмен) и др.
При контакте сорбент поглощает сорбат поверхностью или объемом. Сорбция только поверхностью называется адсорбцией, а только объемом – абсорбцией. Процесс обратный адсорбции называется десорбцией.
Адсорбциясвязана с особым энергетическим состоянием частиц на поверхности адсорбента в отличие от энергетического состояния частиц в его объеме. Частицы во внутренних слоях вещества испытывают одинаковое притяжение со стороны окружающих частиц по всем направлениям.
Частицы же поверхностного слоя подвергаются неодинаковому притяжению со стороны внутренних слоев вещества и со стороны частиц граничащей с веществом посторонней фазы. Поэтому частицы поверхностного слоя адсорбента обладают свободной поверхностной энергией, которая может быть снижена за счет возникновения абсорбционных взаимодействий с молекулами, атомами и ионами адсорбата.
Для границы раздела фаз жидкость – газ (пар) обычно используют термин "удельная (на 1 м2) поверхностная энергия", называемая поверхностным натяжением, которая равно работе образования единицы площади поверхности раздела фаз (Дж/м2).
Поверхностная энергия – это энергия Гиббса ΔG образования поверхности. Она равна произведению удельной поверхностной энергии σ на площадь поверхности раздела фаз S:
ΔG = σS.
Удельная поверхностная энергия зависит от природы вещества. Чем выше энергия взаимодействия между частицами вещества, тем выше удельная поверхностная энергия. С увеличением температуры удельная поверхностная энергия уменьшается.
В зависимости от природы сил взаимодействия адсорбирующего вещества с адсорбентом различают физическую и химическую (хемосорбцию) адсорбцию. В первом случае при адсорбции возникают вандерваальсовы взаимодействия, во втором – химические связи.
Физическая адсорбция характеризуется невысоким тепловым эффектом и обратимостью.
Хемосорбция протекает необратимо. Тепловой эффект ее близок к тепловому эффекту химических реакций.
Изотерма адсорбции
Количественно адсорбцию можно выражать в молях адсорбата на единицу площади адсорбента, моль/м2. Адсорбция зависит от природы адсорбента и адсорбата, температуры и концентрации или давления адсорбата. Кривую зависимости величины адсорбции Г от равновесных концентраций С или давлений р адсорбата при постоянной температуре Т называют изотермой адсорбции:
Г = f(C) или Г = f(p) при Т = const.
Изотерма адсорбции на однородной поверхности адсорбента была выведена американским ученым Дж.Лэнгмюром. При выводе уравнения было сделано предположение, что поверхность адсорбента однородна и при максимальном заполнении образуется мономолекулярный слой. В этом случае уравнение имеет вид:
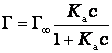
или
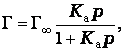
где Г∞ - адсорбция при максимальном заполнении;
с – равновесная концентрация адсорбата;
р – равновесное давление адсорбата;
Ка – константа равновесия процесса адсорбции.
 Графически изотерма адсорбции имеет вид, приведенный на рис. 16
Графически изотерма адсорбции имеет вид, приведенный на рис. 16
Изотерма Лэнгмюра редко соблюдается в реальности, поэтому предложены другие уравнения.
В 1906 г. Фрейндлих предложил эмпирическое уравнение изотермы. Уравнение Фрейндлиха имеет вид:
Г = Кфрn,
где Кф и n – постоянные.
Поверхностно-активные вещества
При адсорбции изменяются свойства поверхностного слоя, т.е. поверхностное натяжение. Адсорбирующиеся вещества могут понижать поверхностное натяжение (это поверхностно - активные вещества – ПАВ), повышать поверхностное натяжение (поверхностно - инактивные вещества) и не влиять на поверхностное натяжение (поверхностно - неактивные вещества).
Широкое применение нашли лишь ПАВ. Способностью уменьшать поверхностное натяжение, т.е. поверхностной активностью обладают молекулы вещества, имеющие неполярные гидрофобные углеводородные части ("хвосты") и полярные гидрофильные группы ("головы"). К полярным принадлежат группы
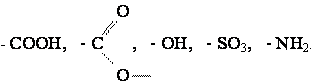
К ПАВ принадлежит натриевая соль стеариновой кислоты, входящей в состав мыла
СН3 ‑ (СН2)16 ‑ СООNa.
Поверхностная активность обусловлена гидрофобной частью молекул ПАВ ("хвостами"), которые выталкиваются из полярного растворителя, в то время как гидрофильные группы ("головы") удерживают молекулы ПАВ на границе раздела фаз. Таким образом, молекулы ПАВ адсорбируются на границе раздела фаз, причем гидрофобная их часть обращена в сторону газа или неполярной жидкости, гидрофильная часть – в сторону полярной жидкости или твердого гидрофильного адсорбента.
Концентрация ПАВ в поверхностном слое на несколько порядков выше, чем в объеме жидкости, поэтому даже при малом содержании ПАВ они значительно снижают поверхностное натяжение. Поверхностная активность ПАВ возрастает с увеличением длины углеводородной части молекул и их концентрации.
Изменение поверхностного натяжения под действием ПАВ влияет на смачиваемость твердых тел жидкостью. Этот эффект используется для очистки тканей (стирка, чистка) или металлов от жировых загрязнений применением ПАВ, при адсорбции которых на границе раздела фаз вода – жир, вода – твердое тело изменяется поверхностное натяжение воды на этих границах, что приводит к переходу жира в виде капель в водную среду.
Применение ПАВ позволяет разделять пустую породу и руду при флотации руд. Пустая порода смачивается водой, содержащей ПАВ, а руда поднимается вверх с пузырьками воздуха, продуваемого через раздробленную породу в воде.
ЛЕКЦИЯ № 5
Дата добавления: 2016-11-26; просмотров: 3907;











