Понятие химического равновесия. Закон действующих масс
При протекании химической реакции через некоторое время устанавливается химическое равновесие. Существует два признака химического равновесия: кинетический, термодинамический. В кинетическом – ?пр = ?обр, в термодинамическом – характеризует химическую реакцию при условиях P, t – const (?G = 0); при условиях V, Т – const (?F =0).
Химический потенциал – функция, которая характеризует состояние i-го компонента при определенных внешних условиях.
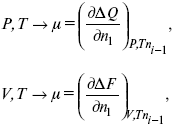
где n1 – число молей i-го компонента.
Если к бесконечно большому количеству раствора прибавить определенное количество какого-нибудь компонента, то химический потенциал системы определяется изменением изобарного потенциала при изобарных условиях или изменением изохорного потенциала при изохорных условиях.
Химический потенциал характеризует способность данного компонента выходить из данной фазы путем испарения, растворения, кристаллизации и т. д. Переход этот происходит произвольно.
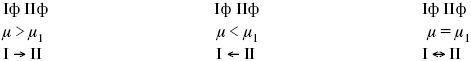
В результате химического равновесия скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается.
Концентрации, которые соответствуют химическому равновесию, называютсяравновесными концентрациями. Связь между равновесными концентрациями устанавливается законом действующих масс (ЗДМ). Этот закон в 1867 г. вывели К. М. Гульберг и П. Вааге.
Расчет равновесного состава химического равновесия
Равновесный состав можно рассчитать только для газовой системы
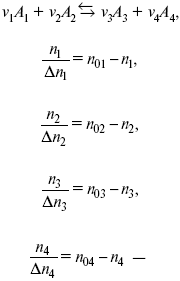
равновесная концентрация.
Исходная концентрация всех компонентов
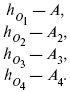
Изменение каждого компонента по числу молей (или стехиометрическому коэффициенту):
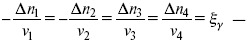
??– (пробег реакции) – химическая переменная.
Она показывает изменение количества вещества по числу молей. Если реакция не началась, то ?? = 0. Если количество исходных веществ превратилось в такое же количество продуктов реакции, то ?? = 1.
3H2 + N2 = 2NH3; ??= 1,
1,5H2 + 0,5N2 = NH3; ??= 0,5,
v1 А 1 + v2А2 = v3А3+ v4А4, – газовая реакция.
Рассчитать равновесный состав по третьему компоненту при условии, что А = а моль/л; В = в моль/л.
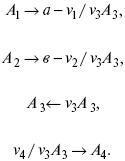
Рассчитываем по 4 компоненту:
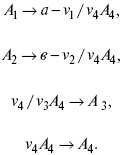
ЛЕКЦИЯ № 3
Дата добавления: 2016-11-26; просмотров: 2018;











