Физические свойства газа
Состояние однородного газа определяется тремя параметрами — абсолютным давлением р, плотностью r и абсолютной температурой Т, из которых только два являются независимыми. Уравнение Ф (р, r, Т) = 0, связывающее эти величины, называется уравнением состояния.
Уравнение Клапейрона для массы газа т, занимающей объем V, имеет вид
pV= mRT, (1.10)
где R — газовая постоянная, измеряемая в СИ в Дж/ (кг • К). Уравнение (1.10) можно записать также в виде
p/r = RT. (1.11)
Уравнение Клапейрона для одного киломоля газа m записывается в виде
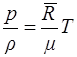 , (1.12)
, (1.12)
где 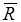 — универсальная газовая постоянная, величина постоянная для всех газов и равная 8314 Дж/ (кмоль • К).
— универсальная газовая постоянная, величина постоянная для всех газов и равная 8314 Дж/ (кмоль • К).
Для воздуха газовая постоянная равна
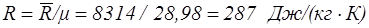 . (1.13)
. (1.13)
Удельный объем газа u и его плотность r связаны соотношением:
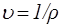 .
.
Газ называется совершенным, если давление р, плотность r и абсолютная температура Т удовлетворяют уравнению Клапейрона (1.11) или (1.12) и удельную внутреннюю энергию газа U можно представить в виде
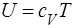 ,
,
где cV — теплоемкость газа при постоянном объеме.
Для реальных углеводородных газов уравнение состояния представляется следующим образом:
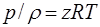 (1.14)
(1.14)
или
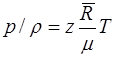 . (1.15)
. (1.15)
Здесь 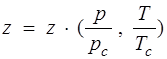 ; (1.16)
; (1.16)
z — коэффициент сжимаемости; рс, Тс — критические давление и температура, т.е. давление и температура в критической точке.
Критической точкой называется точка на карте изотерм (диаграмме состояния р — V — Т) , в которой исчезает различие между насыщенным паром и жидкостью. При температуре выше критической не существует двухфазных состояний. Вещество находится в однофазном состоянии.
Для природных углеводородных газов коэффициент сжимаемости определяется по экспериментальным кривым.
Система находится в термодинамическом равновесии, если параметры, определяющие ее состояние, остаются постоянными.
Обратимым процессом называется процесс изменения состояния системы, который, будучи проведен в обратном направлении, возвращает ее в исходное состояние через те же промежуточные состояния, и при этом в окружающей среде никаких изменений не происходит.
Обратимый процесс можно представить как непрерывную последовательность равновесных состояний, т.е. как квазистатический процесс. Только в том случае, когда реальный процесс может рассматриваться как квазистатический, при выводе формул, описывающих его, можно пользоваться уравнениями равновесного состояния (1.10) — (1.16).
Первое начало термодинамики выражает закон сохранения энергии в применении к преобразованиям механической энергии в тепловую и обратно. Для квазистатических процессов его можно сформулировать следующим образом: подведенное к единице массы газа элементарное количество теплоты dQ расходуется на повышение внутренней энергии газа dU ина выполнение работы расширения pdu :
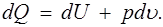 (1.17)
(1.17)
Количество теплоты dQ, сообщенное газу, не является полным дифференциалом, так как зависит не только от начального и конечного состояния газа, но и от самого процесса изменения состояния. Если уравнение (1.17) умножить на интегрирующий множитель 1/Т, то получим полный дифференциал некоторой функции, называемой энтропией:
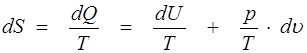 . (1.18)
. (1.18)
При переходе газа из состояния 1 в состояние 2 изменение энтропии S2 — S1 не зависит от процесса перехода, а определяется только начальным и конечным состояниями.
Для совершенного газа
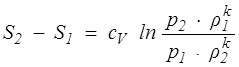 , (1.19)
, (1.19)
где k – сp / cV — показатель адиабаты Пуассона; ср и сV – теплоемкости газа при постоянном давлении и при постоянном объеме соответственно, отнесенные к единице массы. Они измеряются в СИ в Дж/(кг • К). Определенное по формуле (1.19) приращение энтропии тоже отнесено к единице массы.
Процесс, происходящий без теплообмена системы с окружающей средой, называется адиабатическим, а процесс, происходящий при постоянной энтропии, — изоэнтропическим. Изоэнтропический процесс описывается уравнением адиабаты Пуассона, которое получается из уравнения (1.19), если положить S2 = Sl , т.е.
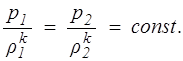 (1.20)
(1.20)
Процесс, происходящий при постоянной температуре, называется изотермическим. Он описывается уравнением Бойля — Мариотта
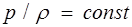 . (1.21)
. (1.21)
Энтальпией, отнесенной к единице массы (или теплосодержание при постоянном давлении), называется функция
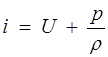 , (1.22)
, (1.22)
которая определяется только состоянием газа, например, его температурой и давлением.
При адиабатическом течении реального газа через дроссель (вентиль, диафрагму и т.д.) из области большего давления pi в область меньшего давления p2 наблюдается изменение температуры, вызванное изменением давления. Это явление называется эффектом Джоуля —Томсона. Если за дросселем восстанавливается начальная скорость течения газа, то энтальпия сохраняется неизменной:
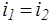 (1.23)
(1.23)
или
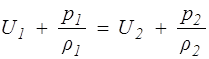 . (1.24)
. (1.24)
Температура в процессе Джоуля — Томсона может как повышаться, так и понижаться, в зависимости от характера сил взаимодействия между молекулами газа. Один и тот же газ при разных температурах может вести себя различно. Температура, при которой эффект меняет свой знак, называется точкой инверсии.
Дифференциальный эффект Джоуля — Томсона характеризуется коэффициентом Джоуля —Томсона
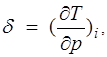 (1.25)
(1.25)
зависящим от температуры и давления.
При дросселировании от высокого давления р1 до значительно более низкого р2 температура газа меняется на конечную величину T1 — Т2. Этот процесс принято называть интегральным эффектом Джоуля — Томсона. Для его характеристики вводится среднее значение коэффициента Джоуля — Томсона
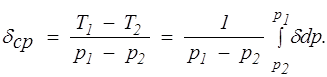
 (1.26)
(1.26)
Для многих реальных газов составлены таблицы и построены графики зависимости энтальпии от температуры и давления, диаграмма i — Т для метана. Эти графики могут служить для расчета эффекта Джоуля — Томсона.
Для совершенного газа
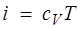 , (1.27)
, (1.27)
и изменение температуры за счет эффекта Джоуля — Томсона равно нулю.
Вопросы по теме 1.2.
1. Какой газ называется совершенным?
2. Какой процесс называется изоэнтропическим?
3. Как изменяется плотность совершенного газа при увеличении давления, если процесс изотермический?
4. Как зависит внутренняя энергия совершенного газа от температуры?
5. Как записывается уравнение состояния реального газа?
Дата добавления: 2016-11-26; просмотров: 1751;











