Строение атомного ядра. Субатомные частицы. Элементы. Изотопы.
Атом состоит из ядра и окружающего его электронного "облака". Находящиеся в электронном облаке электроны несут отрицательныйэлектрический заряд. Протоны, входящие в состав ядра, несут положительный заряд.
В любом атоме число протонов в ядре в точности равно числу электронов в электронном облаке, поэтому атом в целом - нейтральная частица, не несущая заряда.
Атом может потерять один или несколько электронов или наоборот - захватить чужые электроны. В этом случае атом приобретает положительный или отрицательный заряд и называется ионом.
Практически вся масса атома сосредоточена в его ядре, так как масса электрона составляет всего лишь 1/1836 часть массы протона. Плотность вещества в ядре фантастически велика - порядка 1013 - 1014 г/см3. Спичечный коробок, наполненный веществом такой плотности, весил бы 2,5 миллиарда тонн!
Внешние размеры атома - это размеры гораздо менее плотного электронного облака, которое примерно в 100000 раз больше диаметра ядра.
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Масса нейтрона практически не отличается от массы протона.
Электроны, протоны и нейтроны являются главными "строительными деталями" атомов и называются субатомными частицами. Их заряды и массы в кг и в специальных “атомных” единицах массы (а.е.м.) показаны в таблице 2-1.
Таблица 2-1. Субатомные частицы.
| Частица | Заряд | Масса: | |
| кг | а.е.м. | ||
| Протон | +1 | 1,67·10-27 | 1,00728 |
| Нейтрон | 1,67·10-27 | 1,00867 | |
| Электрон | -1 | 9,11·10-31 | 0,000549 |
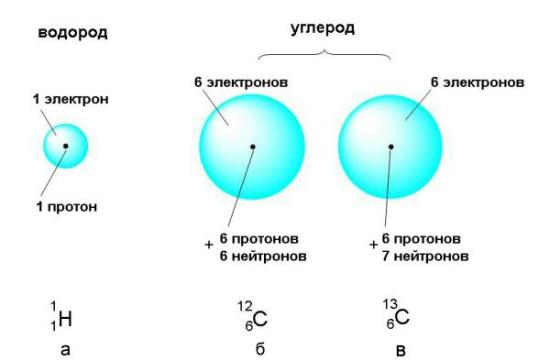
Из таблицы 2-1 видно, что массы субатомных частиц чрезвычайно малы. Показатель степени (например, десять в минус двадцать седьмой степени) показывает, сколько нулей после запятой нужно записать, чтобы получилась десятичная дробь, выражающая массу субатомной частицы в килограммах. Это ничтожнейшая часть килограмма, поэтому массу субатомных частиц удобнее выражать в атомных единицах массы (сокращенно - а.е.м.). За атомную единицу массы принята ровно 1/12 часть массы атома углерода, в ядре которого содержится 6 протонов и 6 нейтронов. Схематическое изображение такого "эталонного" атома углерода приведено на рис. 2-5 (б). Атомнаую единицу массы можно выразить и в граммах: 1 а.е.м. = 1,660540·10-24 г.
 <="" p="">
<="" p="">
Рис. 2-5. Атомы состоят из положительно заряженного ядра и электронного облака. а) В состав ядра атома водорода входит только 1 протон, а электронное облако заполняется одним электроном. б) В ядре атома углерода 6 протонов и 6 нейтронов, а в электронном облаке - 6 электронов. в) Существует также изотопный углерод, ядре которого на 1 нейтрон больше. Содержание этого изотопа в природном углероде составляет чуть более 1% (об изотопах см. ниже). Линейные размеры атомов очень малы: их радиусы составляют от 0,3 до 2,6 ангстрема (1 ангстрем = 10-8 см). Радиус ядра около 10-5 ангстрема, то есть 10-13 см. Это в 100000 раз меньше размеров электронной оболочки. Поэтому правильно показать относительные пропорции ядер и электронных оболочек на рисунке невозможно. Если бы атом увеличился до размеров Земли, то ядро имело бы всего около 60 м в диаметре и могло бы поместиться на футбольном поле.
Масса атома, выраженная в килограммах или граммах, называется абсолютной атомной массой. Чаще пользуются относительной атомной массой, которая выражается в атомных единицах массы (а.е.м.). Относительная атомная масса представляет собой отношение массы какого-нибудь атома к массе 1/12 части атома углерода. Иногда говорят более коротко: атомный вес. Последний термин вовсе не устаревший, как иногда пишут в учебниках - он широко используются в современной научной литературе, поэтому мы тоже будем его применять. Относительная атомная масса и атомный вес, фактически, безразмерные величины (масса какого-либо атома делится на массу части атома углерода), поэтому обозначение "а.е.м." после численного значения обычно опускают (но можно и написать, в этом не будет ошибки). Термины “относительная атомная масса”, “атомная масса”, “атомный вес” в научном химическом языке обычно используются равноправно и между ними просто не делают различий. В Международном союзе химиков (IUPAC) существует Комиссия по относительной распространенности изотопов и атомным весам (Commission on Isotopic Abundances and Atomic Weights или сокращенно – CIAAW), но не "Комиссия по относительным атомным массам". Однако все химики прекрасно понимают, что речь идет об одном и том же.
В российских учебниках и заданиях ЕГЭ пользуются термином относительная атомная масса, которую обозначают символом Ar. Здесь "r" - от английского "relative" - относительный. Например, Ar = 12,0000 – относительная атомная масса углерода 126C равна 12,0000. В современной научной литературе относительная атомная масса и атомный вес - синонимы.
** Из курса физики вы помните, что вес физического тела является переменной величиной. Например, на Земле и на Луне одно и то же физическое тело имеет разный вес, но масса тела - величина постоянная. Поэтому термин “относительная атомная масса” считается более строгим. Для многих вычислений удобно массы протона и нейтрона в шкале а.е.м. считать округленно равными единице.
На рис. 2-5 показаны атомы двух разных видов. Может возникнуть вопрос: почему двух, а не трех видов - ведь на рисунке изображены три атома? Дело в том, что атомы (б) и (в) относятся к одному и тому же химическому элементу углероду, в то время как атом (а) - совсем другой элемент (водород). Что же такое химические элементы и чем они отличаются друг от друга?
Водород и углерод отличаются числом протонов в ядре и, следовательно, числом электронов в электронной оболочке. Число протонов в ядре атома называют зарядом ядра атома и обозначают буквой Z. Это очень важная величина. Когда мы перейдем к изучению Периодического закона, то увидим, что число протонов в ядре совпадает с порядковым номером атома в Периодической таблице Д.И.Менделеева.
Как мы уже говорили, заряд ядра (число протонов) совпадает с числом электронов в атоме. Когда атомы сближаются, то в первую очередь они взаимодействуют друг с другом не ядрами, а электронами. Число электронов определяет способность атома образовывать связи с другими атомами, то есть его химические свойства. Поэтому атомы с одинаковым зарядом ядра (и одинаковым числом электронов) ведут себя в химическом отношении практически одинаково и рассматриваются как атомы одного химического элемента.
Дата добавления: 2016-11-04; просмотров: 1927;











