Термодинамические процессы реальных газов
В качестве реального газа рассмотрим водяной пар, который широко используется во многих отраслях техники, и прежде всего в теплоэнергетике, где он является основным рабочим телом. Поэтому исследование термодинамических свойств воды и водяного пара имеет большое практическое значение.
Процесс парообразования. Основные понятия и определения.Рассмотрим процесс получения пара. Для этого 1 кг воды при температуре 0 °С поместим в цилиндр с подвижным поршнем. Приложим к поршню извне некоторую постоянную силу Р. Тогда при площади поршня F давление будет постоянным и равным p=P/F. Изобразим процесс парообразования, т. е. превращения вещества из жидкого состояния в газообразное, в р,v-диаграмме
Начальное состояние воды, находящейся под давлением р и имеющей температуру 0°С, изобразится на диаграмме точкой a0. При подводе теплоты к воде еетемпература постепенно повышается до тех пор, пока не достигнет температуры кипения ts, соответствующей данному давлению. При этом удельный объем жидкости сначала уменьшается, достигает минимального значения при t=4°С, а затем начинает возрастать. (Такой аномалией — увеличением плотности при нагревании в некотором диапазоне температур — обладают немногие жидкости. У большинства жидкостей удельный объем при нагревании увеличивается монотонно). Состояние жидкости, доведенной до температуры кипения, изображается на диаграмме точкой а'.
При дальнейшем подводе теплоты начинается кипение воды с сильным увеличением объема. В цилиндре теперь находится двухфазная среда — смесь воды и пара, называемая влажным насыщенным паром. По мере подвода теплоты количество жидкой фазы уменьшается, а паровой — растет. Температура смеси при этом остается неизменной и равной ts, так как вся теплота расходуется на испарение жидкой фазы. Следовательно — процесс парообразования на этой стадии является изобарно-изотермическим. Наконец, последняя капля воды превращается в пар, и цилиндр оказывается заполненным только паром, который называется сухим насыщенным. Состояние его изображается точкой а".
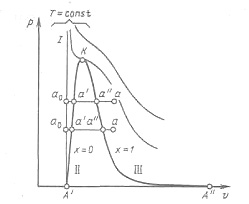
Рисунок 6.1 - р,v-диаграмма водяного пара
Насыщенным называется пар, находящийся в термическом и динамическим равновесии с жидкостью, из которой он образуется. Динамическое равновесие заключается в том, что количество молекул, вылетающих из воды в паровое пространство, равно количеству молекул, конденсирующихся на ее поверхности. В паровом пространстве при этом равновесном состоянии находится максимально возможное при данной температуре число молекул. При увеличении температуры количество молекул, обладающих энергией, достаточной для вылета в паровое пространство, увеличивается. Равновесие восстанавливается за счет возрастания давления пара, которое ведет к увеличению его плотности и, следовательно, количества молекул, в единицу времени конденсирующихся на поверхности воды. Отсюда следует, что давление насыщенного пара является монотонно возрастающей функцией его температуры, или, что то же самое, температура насыщенного пара есть монотонно возрастающая функция его давления.
При увеличении объема над поверхностью жидкости, имеющей температуру насыщения, некоторое количество жидкости переходит в пар, при уменьшении объема «излишний» пар снова переходит в жидкость, но в обоих случаях давление пара остается постоянным.
Насыщенный пар, в котором отсутствуют взвешенные частицы жидкой фазы, называется сухим насыщенным паром. Его удельный объем и температура являются функциями давления. Поэтому состояние сухого пара можно задать любым из параметров — давлением, удельным объемом или температурой.
Двухфазная смесь, представляющая собой пар со взвешенными в нем капельками жидкости, называется влажным насыщенным паром. Массовая доля сухого насыщенного пара во влажном называется степенью сухости пара и обозначается буквой х. Массовая доля кипящей воды во влажном паре, равная 1-х, называется степенью влажности. Для кипящей жидкости х=0, а для сухого насыщенного пара х=1. Состояние влажного пара характеризуется двумя параметрами: давлением (или температурой насыщения ts, определяющей это давление) и степенью сухости пара.
При сообщении сухому пару теплоты при том же давлении его температура будет увеличиваться, пар будет перегреваться. Точка а изображает состояние перегретого пара ив зависимости от температуры пара может лежать на разных расстояниях от точки а". Таким образом, перегретым называется пар, температура которого превышает температуру насыщенного пара того же давления.
Так как удельный объем перегретого пара при том же давлении больше, чем насыщенного, то в единице объема перегретого пара содержится меньшее количество молекул, значит, он обладает меньшей плотностью. Состояние перегретого пара, как и любого газа, определяется двумя любыми независимыми параметрами.
Если рассмотреть процесс парообразования при более высоком давлении, то можно заметить следующие изменения. Точка a0, соответствующая состоянию 1 кг воды при О °С и новом давлении, остается почти на той же вертикали, так как вода практически несжимаема. Точка а' смещается вправо, ибо с ростом давления увеличивается температура кипения, а жидкость при повышении температуры расширяется. Что же касается пара (точка а"), то, несмотря на увеличение температуры кипения, удельный объем пара все-таки падает из-за более сильного влияния растущего давления.
Поскольку удельный объем жидкости растет, а пара падает, то при постоянном увеличении давления мы достигнем такой точки, в которой удельные объемы жидкости и пара сравняются. Эта точка называется критической. В критической точке различия между жидкостью и паром исчезают. Для воды параметры критической точки К составляют: ркр=221,29·105 Па; tкр = 374,15 °С; vкр = 0,00326 м3/кг.
Критическая температура — это максимально возможная температура сосуществования двух фаз: жидкости и насыщенного пара. При температурах, больших критической, возможно существование только одной фазы. Название этой фазы (жидкость или перегретый пар) в какой-то степени условно и определяется обычно ее температурой. Все газы являются сильно перегретыми сверх Tкр парами. Чем выше температура перегрева (при данном давлении), тем ближе пар по своим свойствам к идеальному газу.
Наименьшим давлением, при котором еще возможно равновесие воды и насыщенного пара, является давление, соответствующее тройной точке. Под последней понимается то единственное состояние, в котором могут одновременно находиться в равновесии пар, вода и лед (точка А' на рисунке). Параметры тройной точки для воды: р0 = 611 Па; t0 = 0,01 °С; v0=0,00100 м3/кг. Процесс парообразования, происходящий при абсолютном давлении р0=611 Па, показан на диаграмме изобарой А'А", которая практически совпадает с осью абсцисс. При более низких давлениях пар может сосуществовать лишь в равновесии со льдом. Процесс образования пара непосредственно из льда называется сублимацией.
Если теперь соединить одноименные точки плавными кривыми, то получим нулевую изотерму I, каждая точка которой соответствует состоянию 1 кг воды при 0°С и давлении р, нижнюю пограничную кривую II, представляющую зависимость от давления удельного объема жидкости при температуре кипения, и верхнюю пограничную кривую III, дающую зависимость удельного объема сухого насыщенного пара от давления.
Все точки горизонталей между кривыми II и III соответствуют состояниям влажного насыщенного пара, точки кривой II определяют состояние кипящей воды, точки кривой III — состояния сухого насыщенного пара. Влево от кривой II до нулевой изотермы лежит область некипящей однофазной жидкости, вправо от кривой III — область перегретого пара. Таким образом, кривые II и III определяют область насыщенного пара, отделяя ее от области воды и перегретого пара, и поэтому называются пограничными. Выше точки К, где пограничных кривых нет, находится область однофазных состояний, в которой нельзя провести четкой границы между жидкостью и паром.
Определение параметров воды и пара.Термодинамические параметры кипящей воды и сухого насыщенного пара берутся из таблиц теплофизических свойств воды и водяного пара. В этих таблицах термодинамические величины со штрихом относятся к воде, нагретой до температуры кипения, а величины с двумя штрихами — к сухому насыщенному пару.
Поскольку для изобарного процесса подведенная к жидкости теплота 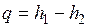 , то, применив это соотношение к процессу а'а", получим
, то, применив это соотношение к процессу а'а", получим
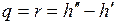 .
.
Величина r называется теплотой парообразования и определяет количество теплоты, необходимое для превращения одного килограмма воды в сухой насыщенный пар той же температуры.
Приращение энтропии в процессе парообразования определяется формулой
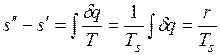 .
.
За нулевое состояние, от которого отсчитываются величины s', принято состояние воды в тройной точке. Так как состояние кипящей воды и сухого насыщенного пара определяется только одним параметром, то по известному давлению или температуре из таблиц воды и водяного пара берутся значения v', v" , h', h" ,s', s", r.
Удельный объем vx, энтропия sx и энтальпия hx влажного насыщенного пара определяются по правилу аддитивности. Поскольку в 1 кг влажного пара содержится x кг сухого и 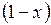 кг кипящей воды, то
кг кипящей воды, то
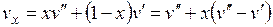 .
.
Аналогично
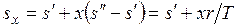 ;
;
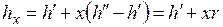 ;
;
Непосредственно из таблиц взять параметры влажного пара нельзя. Их определяют по приведенным выше формулам по заданному давлению (или температуре) и степени сухости.
Однофазные состояния некипящей воды и перегретого пара задаются двумя параметрами. По заданным давлению и температуре из таблиц воды и перегретого пара находят значения v, h, s.
Т, s-диаграмма водяного пара.Для исследования различных процессов с водяным паром кроме таблиц используется Т, s-диаграмма. Она строится путем переноса числовых данных таблиц водяного пара в Т, s-координаты.
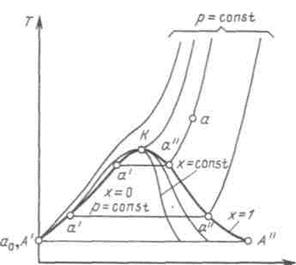
Рисунок 6.2 - T, s-диаграмма водяного пара
Состояние воды в тройной точке (s0 = 0; T0 = 273,16 К) изображается в диаграмме точкой А'. Откладывая на диаграмме для разных температур значения s' и s", получим нижнюю и верхнюю пограничные кривые. Влево от нижней пограничной кривой располагается область жидкости, между пограничными кривыми — двухфазная область влажного насыщенного пара, вправо и вверх от верхней пограничной кривой — область перегретого пара.
На диаграмму наносят изобары, изохоры и линии постоянной степени сухости, для чего каждую изобару а'а" делят на одинаковое число частей и соединяют соответствующие точки линиями x = const. Область диаграммы, лежащая ниже нулевой изотермы, отвечает различным состояниям смеси пар+лед.
h, s-диаграмма водяного пара.Если за независимые параметры, определяющие состояние рабочего тела, принять энтропию s и энтальпию h, то каждое состояние можно изобразить точкой на л, s-диаграмме.
На рисунке 6.3 изображена h, s-диаграмма для водяного пара, которая строится путем переноса числовых данных таблиц водяного пара в h, s-координаты.
За начало координат принято состояние воды в тройной точке. Откладывая на диаграмме для различных давлений значения s' и h'' для воды при температуре, кипения, а также s" и h" для сухого насыщенного пара, получаем нижнюю и верхнюю пограничные кривые.
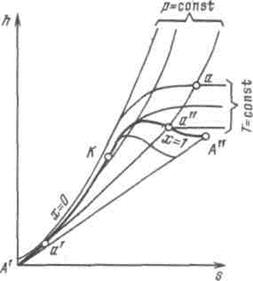
Рисунок 6.3 - h, s-диаграмма водяного пара
Изобары в двухфазной области влажного пара представляют собой пучок расходящихся прямых. Действительно, в процессе р=const 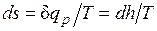 , или
, или 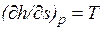 , т.е. тангенс угла наклона изобары в h, s-координатах численно равен абсолютной температуре данного состояния. Так как в области насыщения изобара совпадает с изотермой, тангенс угла наклона постоянен и изобара является прямой. Чем выше давление насыщения, тем выше температура, тем больше тангенс угла наклона изобары, поэтому в области насыщения прямые р = const расходятся. Чем больше давление, тем выше лежит изобара. Критическая точка К лежит не на вершине, как это было в р, v- и Т, s-диаграммах, а на левом склоне пограничной кривой.
, т.е. тангенс угла наклона изобары в h, s-координатах численно равен абсолютной температуре данного состояния. Так как в области насыщения изобара совпадает с изотермой, тангенс угла наклона постоянен и изобара является прямой. Чем выше давление насыщения, тем выше температура, тем больше тангенс угла наклона изобары, поэтому в области насыщения прямые р = const расходятся. Чем больше давление, тем выше лежит изобара. Критическая точка К лежит не на вершине, как это было в р, v- и Т, s-диаграммах, а на левом склоне пограничной кривой.
В области перегрева температура пара (при постоянном давлении) растет с увеличением s примерно по логарифмической кривой и крутизна изобары увеличивается. Аналогичный характер имеют изобары и в области воды, но они идут так близко от пограничной кривой, что практически сливаются с ней.
При низких давлениях и относительно высоких температурах перегретый пар по своим свойствам близок к идеальному газу. Так как в изотермическом процессе энтальпия идеального газа не изменяется, изотермы сильно перегретого пара идут горизонтально. При приближение к области насыщения, т. е. к верхней пограничной кривой, свойства перегретого пара значительно отклоняются от свойств идеального газа и изотермы искривляются.
В h, s-диаграмме водяного пара нанесены также линии v=const, идущие круче изобар.
Обычно всю диаграмму не выполняют, а строят только ее верхнюю часть, наиболее употребительную в практике расчетов. Это дает возможность изображать ее в более крупном масштабе.
Для любой точки на этой диаграмме можно найти р, v, t, h, s, x. Большое достоинство диаграммы состоит в том, что количество теплоты в изобарном процессе равно разности ординат конечной и начальной точек процесса и изображается отрезком вертикальной прямой, а не площадью как в Т, s-диаграмме, поэтому h, s-диаграмма исключительно широко используется при проведении тепловых расчетов.
Основные термодинамические процессы водяного пара.Для анализа работы паросиловых установок существенное значение имеют изохорный, изобарный, изотермический и адиабатный процессы. Расчет этих процессов можно выполнить либо с помощью таблицы воды и водяного пара, либо с помощью h, s-диаграммы. Первый способ более точен, но второй более прост и нагляден.
Общий метод расчета по h, s-диаграмме состоит в следующем. По известным параметрам наносится начальное состояние рабочего тела, затем проводится линия процесса и определяются его параметры в конечном состоянии. Далее вычисляется изменение внутренней энергии, определяются количества теплоты и работы в заданном процессе.
Изохорный процесс. Из диаграммы на рисунке видно, что нагреванием при постоянном объеме влажный пар можно перевести в сухой насыщенный и перегретый. Охлаждением его можно сконденсировать, но не до конца, так как при каком угодно низком давлении над жидкостью всегда находится некоторое количество насыщенного пара. Это означает, что изохора не пересекает нижнюю пограничную кривую.
Рисунок 6.4 - Изохорный процесс водяного пара
Изменение внутренней энергии водного пара при v=const
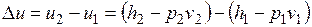 .
.
Данная формула справедлива и для всех без исключения остальных термодинамических процессов.
В изохорном процессе работа 1=0, поэтому подведенная теплота расходуется (в соответствии с первым законом термодинамики) на увеличение внутренней энергии пара:
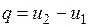
Изобарный процесс.При подводе теплоты к влажному насыщенному пару его степень сухости увеличивается и он (при постоянной температуре) переходит в сухой, а при дальнейшем подводе теплоты — в перегретый пар (температура пара при этом растет). При отводе теплоты влажный пар конденсируется при Ts= const.
Полученная в процессе теплота равна разности энтальпий:
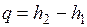 .
.
Работа процесса подсчитывается по формуле:
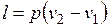 .
.
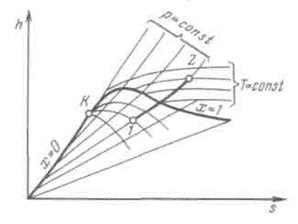
Рисунок 6.5 - Изобарный процесс водяного пара
Изотермический процесс. Внутренняя энергия водяного пара в процессе T = const не остается постоянной (как у идеального газа), так как изменяется ее потенциальная составляющая. Величина 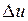 находится по формуле
находится по формуле 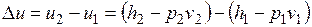 .
.
Количество полученной в изотермическом процессе теплоты равно
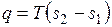 .
.
Работа расширения определяется из первого закона термодинамики:
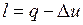 .
.
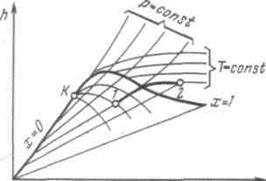
Рисунок 6.6 - Изотермический процесс водяного пара
Адиабатный процесс. При адиабатном расширении давление и температура пара уменьшаются, и перегретый пар становится сначала сухим, а затем влажным. Работа адиабатного процесса определяется выражением
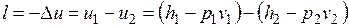 .
.
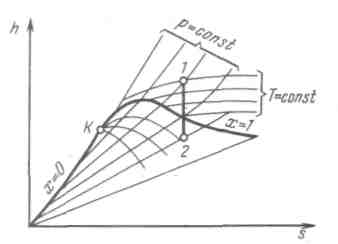
Рисунок 6.7 - Адиабатный процесс водяного пара
Уравнение состояния реальных газов
В реальных газах вотличие от идеальных существенны силы межмолекулярных взаимодействий (силы притяжения, когда молекулы находятся на значительном расстоянии, и силы отталкивания при достаточном сближении их друг с другом) и нельзя пренебречь собственным объемом молекул.
Наличие межмолекулярных сил отталкивания приводит к тому, что молекулы могут сближаться между собой только до некоторого минимального расстояния. Поэтому можно считать, что свободный для движения молекул объем будет равен 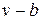 , где b — тот наименьший объем, до которого можно сжать газ. В соответствии с этим длина свободного пробега молекул уменьшается и число ударов о стенку в единицу времени, а следовательно, и давление увеличивается по сравнению с идеальным газом в отношении
, где b — тот наименьший объем, до которого можно сжать газ. В соответствии с этим длина свободного пробега молекул уменьшается и число ударов о стенку в единицу времени, а следовательно, и давление увеличивается по сравнению с идеальным газом в отношении 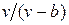 , т. е.
, т. е.
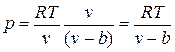 .
.
Силы притяжения действуют в том же направлении, что и внешнее давление, и приводят к возникновению молекулярного (или внутреннего) давления. Сила молекулярного притяжения каких-либо двух малых частей газа пропорциональна произведению числа молекул в каждой из этих частей, т. е. квадрату плотности, поэтому молекулярное давление обратно пропорционально квадрату удельного объема газа: рмол = а/v2, где а — коэффициент пропорциональности, зависящий от природы газа.
Отсюда получаем уравнение Ван-дер-Ваальса (1873 г.):
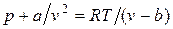 ,
,

 или
или
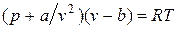 .
.
При больших удельных объемах и сравнительно невысоких давлениях реального газа уравнение Ван-дер-Ваальса практически вырождается в уравнение состояния идеального газа Клапейрона, ибо величина a/v2
(по сравнению с p) и b (по сравнению с v) становятся пренебрежимо малыми.
Уравнение Ван-дер-Ваальса с качественной стороны достаточно хорошо описывает свойства реального газа, но результаты численных расчетов не всегда согласуются с экспериментальными данными. В ряде случаев эти отклонения объясняются склонностью молекул реального газа к ассоциации в отдельные группы, состоящие из двух, трех и более молекул. Ассоциация происходит вследствие несимметричности внешнего электрического поля молекул. Образовавшиеся комплексы ведут себя как самостоятельные нестабильные частицы. При столкновениях они распадаются, затем вновь объединяются уже с другими молекулами и т. д. По мере повышения температуры концентрация комплексов с большим числом молекул быстро уменьшается, а доля одиночных молекул растет. Большую склонность к ассоциации проявляют полярные молекулы водяного пара.
ЛЕКЦИЯ 7
Дата добавления: 2016-11-04; просмотров: 3307;











