Тема 3. Пищевые продукты. Особенности их реологического поведения
Большинство объектов, подвергаемых реологическим исследованиям представляют собой, так называемые, дисперсные системы. Именно для последних особенно характерны существенные отклонения от классических законов деформации и течения.
Дисперсные системы– это такие системы, в которых одно вещество в виде частиц различной величины распределено в другом веществе.
В дисперсных системах различают дисперсную фазу (ДФ) – мелкораздробленное вещество и дисперсионную среду (ДС) – однородное вещество, в котором распределена дисперсная фаза (в мутной воде, содержащей глину, ДФ являются твердые частички глины, а ДС – вода).
Важной характеристикой дисперсных систем является степень дисперсности – средний размер частиц дисперсной фазы.
По степени дисперсности выделяют обычно следующие классы дисперсных систем:
Грубодисперсные системы – системы, размер частиц дисперсной фазы в которых превышает 10-7 м (суспензии и эмульсии).
Коллоидные системы – системы, размер частиц дисперсной фазы в которых составляет 10-7 – 10-9 м. Это микрогетерогенные системы с хорошо развитой поверхностью раздела между фазами. Их частицы не оседают под действием силы тяжести, проходят через бумажные фильтры, но задерживаются растительными и животными мембранами. Например, растворы белков, почвенные коллоиды и т.д.
Иногда выделяют молекулярно(ионно)-дисперсные системы, которые, строго говоря, являются истинными растворами, т.е. гомогенными системами, поскольку в них нет поверхностей раздела фаз. Размер частиц дисперсной фазы менее 10-9 м. Растворенное вещество находится в виде молекул или ионов. Например, растворы электролитов, сахара.
Нижний предел дисперсности коллоидной системы составляет 20-30 молекул с размером 1-6 нм.
Коллоидные системы, в свою очередь, подразделяются на две группы, резко отличные по характеру взаимодействий между частицами дисперсной фазы и дисперсионной среды – лиофобные коллоидные растворы (золи) и лиофильными коллоиды, к которым раньше относили растворы высокомолекулярных соединений. К лиофильным системам относятся мицеллы поверхностно-активных веществ.
Лиофильные системы образуются самопроизвольно благодаря сильному взаимодействию частиц дисперсной фазы с дисперсионной средой и способны сохранять устойчивость без стабилизаторов. Масло, маргарин, майонез, сметана, сливки, молоко, представляют собой типичные сложные коллоидные дисперсные системы. Обязательным условием получения дисперсных систем является взаимная нерастворимость диспергируемого вещества и дисперсионной среды. Например, нельзя получить коллоидные растворы сахара или поваренной соли в воде, но они могут быть получены в керосине или в бензоле, в которых эти вещества практически нерастворимы.
К лиофобным коллоидам относятся системы, в которых частицы дисперсной фазы слабо взаимодействуют с дисперсионной средой; эти системы могут быть получены только с затратой энергии и устойчивы лишь в присутствии стабилизаторов. Лиофобные системы по определению должны обладать избытком поверхностной энергии, если она не скомпенсирована введением стабилизаторов. Поэтому в них самопроизвольно идут процессы укрупнения частиц, т.е. происходит снижение поверхностной энергии за счет уменьшения удельной поверхности. Такие системы называют агрегативно неустойчивыми. Фактически, под агрегативной устойчивостью понимают способность системы сохранять межфазную поверхностную энергию границ раздела частиц дисперсной фазы с дисперсионной средой
Укрупнение частиц может идти разными путями. Один из них, называемый изотермической перегонкой, заключается в переносе вещества от мелких частиц к крупным (эффект Кельвина). В результате мелкие частицы постепенно растворяются (испаряются), а крупные – растут.
Второй путь, наиболее характерный и общий для дисперсных систем, представляет собой коагуляцию(от лат, свертывание, затвердение), заключающуюся в слипании частиц. Также возможна и коалисценция –слияние частиц.
Коагуляция в разбавленных системах также приводит к потере седиментационной устойчивости (противодействие оседанию частиц под действием силы тяжести) и в конечном итоге к расслоению (разделению) фаз.
Агрегативная неустойчивость крупных частиц определяет верхний порог существования коллоидных частиц.
Дисперсная фаза лиофильных дисперсных систем называется мицеллой, а лиофобных – сложной структурной единицей.
Количественной характеристикой дисперсности (раздробленности) вещества является степень дисперсности (степень раздробленности, D) – величина, обратная размеру дисперсных частиц.
При уменьшении размеров и повышении дисперсности возрастает характерная для всяких гетерогенных систем внутренняя поверхность раздела между фазами, все большее и большее число атомов вещества находится в поверхностном слое (на границе раздела фаз) по сравнению с их числом внутри объема частиц дисперсной фазы, т.е. заметнее роль граничных слоев и связанных с ними поверхностных явлений. В табл. 1 приведены отличительные особенности коллоидных систем в сравнении с истинными растворами и грубодисперсными системам.
Многообразие дисперсных систем обусловлено также тем, что образующие их фазы могут находиться в любом из трех агрегатных состояний. При схематической записи агрегатного состояния дисперсных систем обычно используют дробь: в числителе указывают буквами Г (газ), Ж (жидкость) или Т (твердое) агрегатное состояние дисперсной фазы, а в знаменателе указывают агрегатное состояние дисперсионной среды (табл. 2). В связи с неограниченной взаимной растворимости газов дисперсионные системы Г/Г при классификации обычно не указывают.
Таблица 1 – Характеристика дисперсных систем
| Свойства частиц | Грубодисперсные системы (суспензии и эмульсии) | Коллоидные системы | Истинные растворы |
| Размеры | 10-2 -10-5 см | 10-5-10-7 см | 10–7 см и менее |
| Диффузия | Отсутствует | Очень слабо выражена | Хорошо выражена |
| Фильтрация | Частицы не проходят через бумажный фильтр | Частицы проходят через бумажный фильтр | Частицы (молекулы) проходят через бумажный и ультрафильтры |
| Проходимость через мембрану | Не проходят | Не проходят | Проходят |
| Видимость в обычном микроскопе | Видимы | Невидимы | Невидимы |
| Видимость в ультрамикроскопе | Видимы | Обнаруживаются | Невидимы |
| Видимость в электронном микроскопе | Видимы | Видимы | Видимы только наиболее крупные молекулы |
| Поверхностная энергия | Проявляется слабо | Проявляется | Отсутствует |
Таблица 2 – Классификация дисперсионных систем
по агрегатному состоянию
| Дисперсионная среда | Дисперсная фаза | ||
| газ | жидкость | твердое тело | |
| Газ | - | Аэрозоль (туман, облако) | Аэрозоль (дым, пыль) |
| Жидкость | Пена (мыльная пена) | Эмульсия (масло сливочное, маргарин, кремы) | Суспензия (молоко) и коллоидные растворы |
| Твердое тело | Пористые и капиллярные системы (пемза, пенолпласты) | Пористые тела, гели (вода в парафине, жемчуг) | Твердые коллоидные растворы (окрашенные стекла, сплавы) |
Дисперсные системы могут быть свободнодисперсными и связнодисперсными в зависимости от отсутствия или наличия взаимосвязи между частицами дисперсной фазы. К свободнодисперсным системам относятся аэрозоли, разбавленные суспензии и эмульсии. Они текучи, в этих системах частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести. Связнодисперсные системы – твердообразны; они возникают при контакте частиц дисперсной фазы, приводящем к образованию структуры в виде каркаса или сетки. Такая структура ограничивает текучесть дисперсной системы и придает ей способность сохранять форму. Порошки, концентрированные эмульсии и суспензии (пасты), пены, гели – примеры связнодисперсных систем.
В таблице 3 приведены сложные дисперсные системы пищевых продуктов, а в таблице 4 и 5 – классификация пищевых продуктов по реологическим свойствам
Таблица 3 – Сложные дисперсные системы пищевых продуктов
| Продукт | Дисперсная фаза | Дисперсионная среда |
| Шоколад | Кристаллы сахара, твердые частицы какао, пузырьки воздуха | Кристаллическая форма какао-масла |
| Мороженое | Пузырьки воздуха, капельки жира, белковые макромолекулы | Кристаллическая водянистая фаза |
| Мякиш хлеба | Пузырьки воздуха, частично кристаллические молекулы крахмала, частицы отрубей | Крахмальный и белковый гель |
| Фрукты, овощи, картофель, зерно, масличные семена | Капельки жидкости, пузырьки воздуха, крахмальные зерна | Целлюлоза, белковая обо-лочка |
| Мясо | Капельки жидкости, кости, капельки жира | Белковые макромолекулы |
| Дисперсионная среда | Дисперсная фаза | Название системы | Примеры |
| Газ | Твердая | Пыль, дым | Сухой порошок (мука) в воз- духе |
| Жидкая | Туман | Дисперсия молока в распылительной сушилке | |
| Жидкость | Твердая | Суспензия | Плодоовощные соки с мяко- тью, сырковая масса, колбас- ный фарш |
| Жидкая | Эмульсия | Масло в воде, молоко | |
| Газообразная | Пена | Крем, взбитые сливки | |
| Твердое тело | Твердая | Твердая сус- пензия, сплав | Замороженное мясо |
| Жидкая | Твердая эмульсия | Сливочное масло | |
| Газообразная | Пористое тело | Сыр |
Таблица 5 – Классификация пищевых продуктов
по реологическим свойствам
| Дисперсная система | Продукт (в том числе сырье, полуфабрикат) | Типичные реологические свойства |
| Чистая жидкость | Вода, спирт, масло | Ньютоновская вязкость |
| Чистый расплав | Расплавленные жиры (какао-масло), | Преимущественно ньютоновская вязкость |
| Истинный раствор | Солевые и сахарные растворы, экстракты, пиво | То же |
| Коллоидный раствор | Белковые растворы, мутные фруктовые и ягодные соки | Ньютоновская вязкость, возможны вязкоупругость, тиксотропия |
| Жидкообразная | Суспензии (какао, фруктовые и овощные соки, супы), эмульсии (молоко, сливки, майонез) | Ньютоновская и неньютоновская вязкость, тиксотропия, вязкоупругость |
| Пастообразная | Фруктовое пюре (яблочный мусс), ореховый мусс, творог, фарш |  Неньютоновская вязкость, тиксотропия, реопексия, вязкоупругость Неньютоновская вязкость, тиксотропия, реопексия, вязкоупругость
|
| Связанная мягкая | Масло, пенная масса, желе, тесто, йогурт, суп, паштет, картофельное пюре | Пластичная вязкость, обратимая и необратимая тиксотропия, упругость, вязкоупругость |
| Связанная полутвердая | Мякиш хлеба, вареная колбаса, вареный картофель | Упругость, пластичная вязкость, вязкоупругость |
| Прочная | Свежие яблоки, груши, картофель, огурцы, мясо, хлебобулочные продукты длительного хранения, шоколад, конфеты | Упругость, пластичная вязкость, вязкоупругость |
| Твердая | Карамель, зерно, ядра орехов, макаронные изделия, морковь | Упругость, твёрдость, высокая текучесть и прочность, хрупкость |
В зависимости от концентрации дисперсной фазы дисперсные системы также подразделяют на три группы:
1) разбавленные, содержащие до 0,1 %об. дисперсной фазы;
2) концентрированные, содержащие от 0,1 до 74 %об. дисперсной фазы;
3) высококонцентрированные, содержание свыше 74 % об. дисперсной фазы.
Наиболее сложными реологическими свойствами обладают высоко-коцентрированные дисперсные системы с пространственными структурами.
Для описания течения различных пищевых материалов чаще других применяется степенное уравнение Оствальд-де-Виля
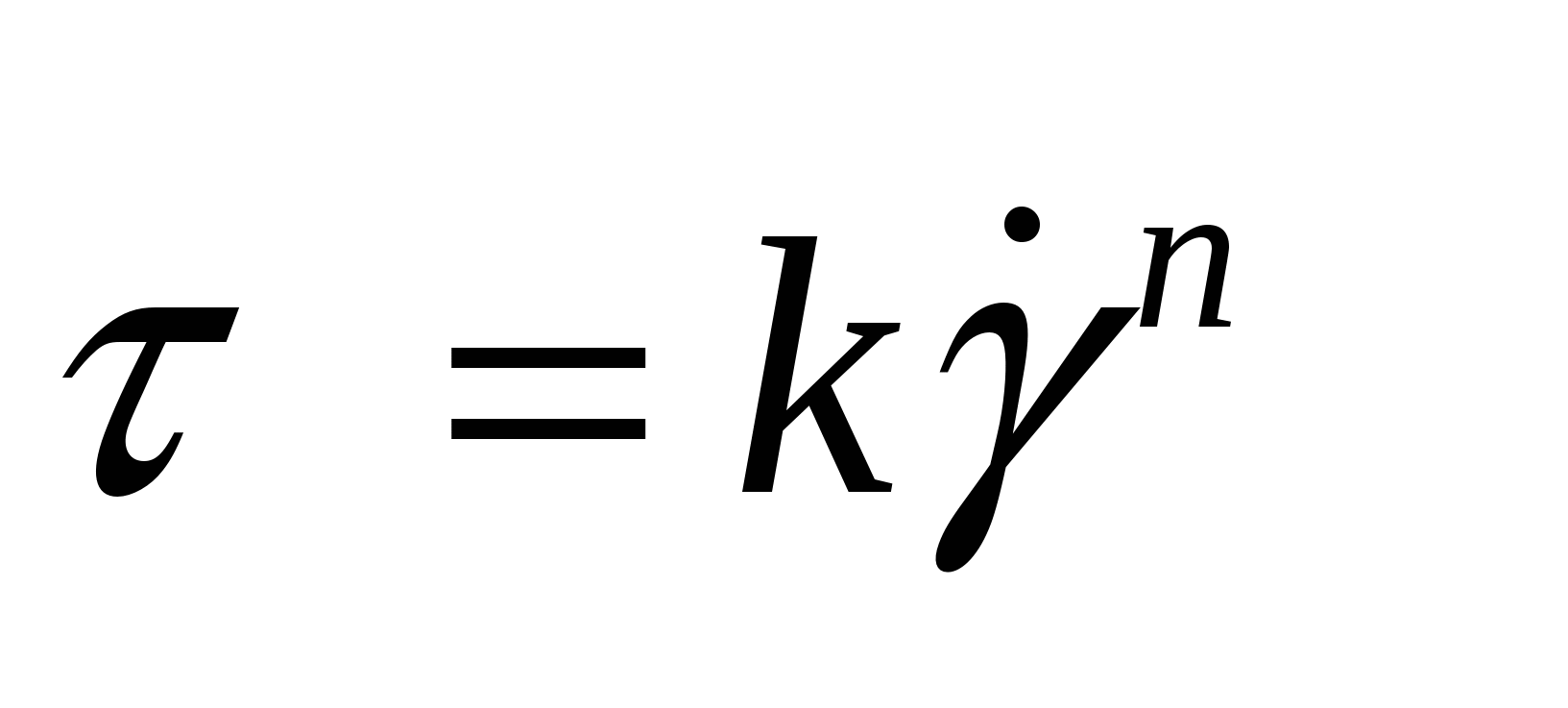 , где К и n -константы
, где К и n -константы
При n <1 уравнение соответствует кривой, в соответствии с рисунком 12а (при n =1 степенной закон сводится к выражению Ньютона).
Уравнение Оствальда имеет две константы: К – коэффициент консистенции, зависящий как от природы материала, так и от вида и размеров измерительной аппаратуры, и n – индекс течения. Коэффициент К наиболее чувствителен, по сравнению с n, к изменению температуры материала, что особенно важно отметить для пищевых сред. Константы уравнения справедливы только для определенного диапазона скоростей сдвига.
При значении n <1 вязкость уменьшается с повышением скорости сдвига, что соответсвует псевдопластичномув поведению материалаю Это реологическое свойство объясняют тем, что в неподвижной среде расположение частиц характеризуется значительной хаотичностью, а под действием возрастающих сил происходит все большая ориентация частиц в направлении течения. С повышением скорости также уменьшается взаимодействие между частицами.
Степенной закон получил широкое распространение для выражения течения различных неньютоновских пищевых материалов: томатных концентратов, сахарных растворов, абрикосового пюре, хлебопекарного теста, конфетных масс и других материалов.
Кривая течения, изображенная на рисунке 12 (б), описывается уравнением Штейгера
( здесь С и А – эмпирические константы).
Встречаются и такие псевдопластические вещества, у которых пропорциональность между 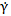 и τ наблюдается только при очень высоких скоростях сдвига, в соответствии с рисунком 12 в.
и τ наблюдается только при очень высоких скоростях сдвига, в соответствии с рисунком 12 в.
в)
Рис. 12. Кривые течения некоторых псевдопластичных пищевых материалов
У пищевых материалах может встречаться не только псевдопластичное, но и дилатантное течение в соответствии с рисунком 13 (а). Это течение описывается уравнениями Оствальда при n >1. При очень высоких напряжениях вязкость может стать бесконечно большой, что приведет к разрушению вещества.
В дисперсных системах в зависимости от концентрации, а также величины нагрузки может возникнуть ситуация, когда при значениях напряжения, меньших предельного, дисперсная система ведет себя как твердое тело и упруго деформируется. Если напряжение, действующее на систему, превышает предельное, то наступает пластическое течение. Для описания течения пластических материалов предложеноуравнение Бингама 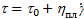 в котором τ0 - предельное напряжение сдвига (предел текучести), Па; hпл - пластическая вязкость, Па⋅с (рис.13 б). Примером систем, довольно близко следующих уравнению Бингама, могут служить маргарин, шоколадные смеси, сырково-творожные и пралиновые массы, зубная паста, жидкие мыла и моющие средства.
в котором τ0 - предельное напряжение сдвига (предел текучести), Па; hпл - пластическая вязкость, Па⋅с (рис.13 б). Примером систем, довольно близко следующих уравнению Бингама, могут служить маргарин, шоколадные смеси, сырково-творожные и пралиновые массы, зубная паста, жидкие мыла и моющие средства.
Кривые течения некоторых пищевых материалов (например, масса для конфет "Русский узор") описываются уравнением Балкли-Гершеля, в соответствии с рисунком 13 (в).
Если изменения вязкости связаны не только со скоростью, но и со временем, то говорят о тиксотропии, антитиксотропии или реопексии.
Напомним, что материал считается тиксотропным, когда вязкость его является функцией времени, причем предполагается, что структура после определенного времени покоя возвращается к первоначальному состоянию. Время тиксотропного разрушения, так же как и восстановления, для различных структур изменяется в очень широких пределах.
Будет ли пищевой материал обладать тиксотропными свойствами может быть определено по реограмме при получении кривой гистерезиса. В соответствии с рисунком 13 (г), показана одна из разновидностей петли гистерезиса, построенной по результатам одного эксперимента, в течение которого скорость сдвига постоянно растет от нуля до максимального значения, а затем немедленно снижается до нуля (на рисунке показано стрелкой). Следует отметить, что для одного и того же материала вид петли будет разным при различном времени испытания. Примером тиксотропных пищевых материалов могут служить: бараночное тесто, пралиновые и трюфельные конфетные массы, какао тертое, мясной фарш.
Материалы, состояние течения которых во времени являются противоположным тому, какое дают тиксотропные системы, называю антитиксотропными, в соответствии с рисунком 13 (д).
Материалы, структура которых во времени упрочняется, обладают свойствами реопексии, в соответствии с рисунком 13 (е). Такие материалы, относимые иногда к антитиксотропным, относительно редко встречаются в нашей практике. Петли гистерезиса для этих материалов могут быть получены так же, как идля тиксотропных. При расчете технологических процессов тиксотропные свойства перерабатываемых пищевых среду читывают в момент пуска оборудования после продолжительного выстоя, а реопексные – после интенсивного сдвига.
Рис.13. Кривые течения разнообразных пищевых материалов.
Дата добавления: 2016-11-04; просмотров: 5741;











