ДВУХКОМПОНЕНТНЫХ СИСТЕМ
Изучить приемы анализа диаграмм состояния двухкомпонентных систем, получить навыки в использовании диаграмм состояния для описания превращений в сплавах.
6.2 Кристаллизация и формирование структуры неограниченных твердых растворов
Диаграммы состояния являются наглядным изображением фазового состояния сплавов в равновесных условиях в зависимости от температуры и состава. Диаграммы состояния используют для решения ряда задач. На примере диаграммы состояния системы двухкомпонентных сплавов с неограниченной растворимостью компонентов в жидком и твердом состоянии (система Cu – Ni), приведенной на рисунке 6.1, а, рассмотрены основные задачи, решаемые с помощью диаграммы состояния, и методы их решения. Подобная диаграмма состояния (диаграмма II рода) условной двухкомпонентной системы А – В приведена также на рисунке А.2.
|
а б
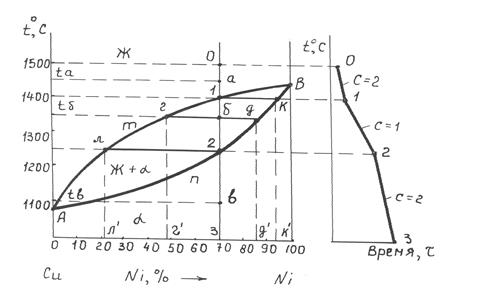
Рисунок 6.1 – Диаграмма состояния системы «медь – никель» (а)
и кривая охлаждения (б)
Линия АтВ – линия ликвидуса, выше нее все сплавы находятся в жидком состоянии (Ж). Линия АпВ – линия солидуса, ниже нее все сплавы находятся в твердом состоянии. Сплавы рассматриваемой системы в твердом состоянии представляют собой твердые растворы α.
По диаграмме состояния могут быть решены следующие задачи.
1. Определение температуры критических точек. Для решения этой задачи необходимо найти проекции на ось температур точек пересечения линии сплава (вертикальной линии, проходящей через точку оси концентраций, соответствующую составу заданного сплава) с линиями диаграммы. Так, сплав, содержащий 30 % Сu и 70 % Ni (сплав І), имеет следующие температуры критических точек (см. рисунок 6.1, а): 1 400 °С (точка 1 – начало кристаллизации) и 1 250 °С (точка 2 – конец кристаллизации).
2. Определение фазового состояния сплава в различных температурных интервалах. Для решения этой задачи необходимо через точки, характеризующие определенные температуры в различных температурных интервалах охлаждения сплава, провести горизонтальные линии (изотермы) до пересечения с линией сплава.
Области расположения точек пересечения определяют фазовое состояние сплава. Так, пусть сплав І (см. рисунок 6.1, а) охлажден до температур, например: ta = 1 450 °С, tб = 1 350 °С, tв = 1 100 °С. Проведем изотермы ta, tб, tв. Точки пересечения а, б и в характеризуют фазовое состояние сплава при рассматриваемых температурах. Так, при температуре ta (температурный интервал t0 – t1) сплав состоит из одной фазы (Ж), при температуре tб (интервал t1 – t2) сплав состоит из двух фаз (Ж + α) и при температуре tв (интервал t2 – t3) – из одной фазы (α).
3. Определение химического состава фаз сплава, находящихся в равновесии (в двухфазной области). Решение этой задачи для области двухфазного состояния сплава (интервал кристаллизации) осуществляется с помощью первого положения правила отрезков. Для этого необходимо через точку на линии сплава (например, точку б на рисунке 6.1, а), характеризующую его состояние при соответствующей температуре (tб = 1350 °С), провести горизонтальную линию (коноду) до пересечения с линиями диаграммы, ограничивающими данную двухфазную область. Проекции точек пересечения на ось концентрации укажут состав фаз. Так, проекция г/ точки г на ось концентрации указывает химический состав жидкой фазы, а проекция д/ точки д – твердой фазы. В рассматриваемом сплаве при температуре 1 350 °С существует жидкая фаза, содержащая 48 % Ni и 52 % Сu (точка г/), и твердая фаза α, содержащая 86 % Ni и 14 % Сu (точка д/).
Первое положение правила отрезков позволяет также провести анализ изменения химического состава фаз сплава в рассматриваемой двухфазной области – температурном интервале кристаллизации (t1 – t2). Так жидкая фаза в указанном интервале изменяет свой химический состав по линии ликвидуса от точки 1 до точки л, а твердая фаза – по линии солидуса от точки к до точки 2 (составы фаз указывают проекции этих точек на ось концентраций). Таким образом, состав жидкости изменяется от 30 % Сu + 70 % Ni до 78 % Cu + 22 % Ni, а состав α- твердогораствора – от 7 % Сu + 93 % Ni до 30 % Сu + 70 % Ni.
4. Определение количественного соотношения между фазами сплава в двухфазной области. Эту задачу решают с помощью второго положения правила отрезков (правила рычага). Согласно этому положению весовые количества фаз сплава, находящиеся в равновесии при определенной температуре, обратно пропорциональны отрезкам коноды.
Обозначим: q – общая масса сплава;
qж – масса жидкой фазы;
qα – масса α-твердого раствора.
Согласно правилу отрезков при tб = 1 350 °С:
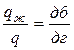 ,
, 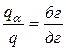 , (6.1)
, (6.1)
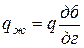 ,
, 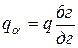 . (6.2)
. (6.2)
Подставляя в эти выражения координаты точек по оси концентрации (например, значения концентрации Ni), получим:
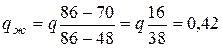 q (6.3)
q (6.3)
(42 % от массы всего сплава составляет жидкая фаза);
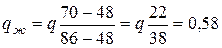 q (6.4)
q (6.4)
(58 % от массы всего сплава составляет твердая фаза) при рассматриваемой температуре tб = 1350 °С.
Необходимо еще раз подчеркнуть, что правило отрезков может быть использовано только для областей двухфазного состояния сплавов.
5. Анализ кристаллизации сплава и построение кривой охлаждения. Рассмотрим с помощью диаграммы состояния процесс кристаллизации сплава І при медленном охлаждении от температуры 1500 °С (точка 0 – см. рисунок 6.1, а). При медленном охлаждении до температуры, соответствующей точке 1, сплав находится в жидком состоянии. Линия 0 – 1 на кривой охлаждения сплава характеризует условия этого охлаждения (см. рисунок 6.1, б). В соответствии с правилом фаз (С = К – Ф + 1, где К – число компонентов, Ф – число фаз, С – число степеней свободы), условия равновесного существования сплава (т. е. без изменения фазового состава) на этом участке будут С = 2 – 1 + 1 = 2 (двухвариантное равновесие). Это означает, что сплав будет сохранять однофазное состояние при некотором изменении двух воздействующих факторов, один из которых температура.
В точке 1 начинается кристаллизация сплава. Это соответствует перегибу на кривой охлаждения сплава в точке 1 (критическая точка), связанному с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации. Поэтому кривая охлаждения сплава в интервале кристаллизации t1 – t2 более пологая (см. рисунок 6.1, б).
При кристаллизации из жидкого сплава возникают кристаллы твердого раствора меди и никеля, который условно обозначается буквой α. Процесс кристаллизации протекает при понижающейся температуре, т. к. согласно правилу фаз число степеней свободы будет равно единице (С = 2 – 2 + 1 = 1 – одновариантноеравновесие).
При достижении температуры, соответствующей точке 2 (см. рисунок 6.1, а), сплав полностью затвердевает, и при более низких температурах существует только α-твердый раствор. Вместе с завершением процесса кристаллизации прекращается выделение тепла системой, и в условиях непрерывного охлаждения ускорится процесс отвода тепла – участок 2–3 на рисунке 6.1, б. Моменту окончания кристаллизации соответствует перегиб на кривой охлаждения сплава в точке 2 (критическая точка).
При кристаллизации составы жидкости и вырастающих кристаллов α-твердого раствора в соответствии с правилом отрезков будут изменяться (см. рисунок 6.1, а): состав жидкости – по линии ликвидуса от точки 1 (30 % Сu + 70 % Ni) до точки л (78 % Сu + 22 % Ni), а состав кристаллов – по линии солидуса от точки к (7 % Сu + 93 % Ni) до точки 2 (30 % Сu + 70 % Ni). Таким образом, кристаллы твердого раствора будут иметь переменный состав.
В то же время при медленном охлаждении в фазах сплава будет происходить выравнивающая диффузия, что способствует усреднению их составов. Однако процесс диффузии происходит медленно, поэтому в практических условиях состав кристаллов после окончания кристаллизации (ниже линии солидуса) не успевает выравниваться, и они оказываются химически неоднородными. Поскольку кристаллы имеют, как правило, форму дендритов, то их оси, которые при кристаллизации возникают первыми, оказываются обогащенными никелем (более тугоплавким компонентом), а межосевое пространство – медью (более легкоплавким компонентом).
Такая химическая неоднородность в пределах дендритного кристалла называется дендритной, или внутрикристаллической, ликвацией.
6. Определение структуры сплава Ni–Сu в различных температурных интервалах. В температурном интервале t0 – t1 (см. рис. 6.1, а) сплав находится в жидком (однофазном) состоянии. Таким образом, структура (строение) сплава при этих температурах будет однофазной – жидкость (Ж). Условно структура сплава приведена на рисунке 6.2, а.
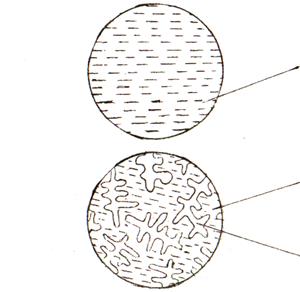
|
|
|

а – в интервале t0 – t1; б – в интервале t1 – t2; в – в интервале t2 – t3
Рисунок 6.2 – Схема структуры сплава Ni – Cu
В интервале кристаллизации сплава t1 – t2 он находится в двухфазном состоянии (Ж + α), как уже было показано ранее. При кристаллизации из жидкости образуются кристаллы твердого раствора α, как правило, дендритной формы. В результате структура сплава будет двухфазной и состоять из кристаллов твердого раствора и жидкости (рисунок 6.2, б).
В температурном интервале t2 – t3структура сплава будет однофазной и состоять из кристаллов твердого раствора. Схематично структура сплавов в твердом состоянии приведена на рисунке 6.2, в.
6.3 Кристаллизация и формирование структуры сплавов с эвтектикой
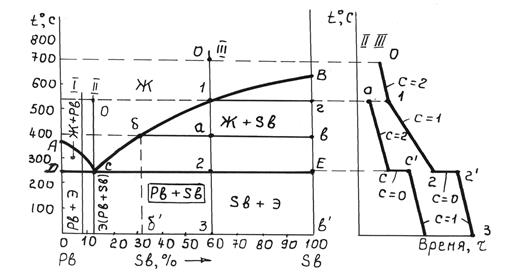
На примере диаграммы состояния системы Pb – Sb, приведенной на рисунке 6.3, рассмотрены основные приемы анализа превращений и формирования структуры сплавов с практической нерастворимостью компонентов в твердом состоянии. Аналогичная диаграмма состояния (диаграмма I рода) условной двухкомпонентной системы А – В приведена также на рисунке А.1.
а б
Рисунок 6.3 – Диаграмма состояния системы Pb–Sb (а)
и кривые охлаждения сплавов (б)
Линия АСВ – линия ликвидуса, выше этой линии сплавы рассматриваемой системы находятся в жидком состоянии. Линия ДСЕ – линия солидуса, ниже этой линии все сплавы этой системы находятся в твердом состоянии в виде механической смеси кристаллов чистых компонентов (смесь двух твердых фаз). У сплавов Pb – Sb это смесь кристаллов свинца и сурьмы (двухфазное состояние – Pb + Sb).
Сплавы, соответствующие по составу точке С (в данной системе – 13 % Sb), называются эвтектическими, расположенные на диаграмме левее точки С – доэвтектическими и расположенные правее точки С – заэвтектическими. Эти сплавы отличаются не только по химическому составу, но и по структуре.
Рассмотрим процесс кристаллизации эвтектического сплава ІІ.
Этот сплав является самым легкоплавким. При охлаждении данного сплава в температурном интервале t0 – tс он находится в жидком (однофазном) состоянии. Процесс охлаждения описывается линией 0 –С на кривой охлаждения сплава (см. рис. 6.3, б). На этом участке охлаждения число степеней свободы С = К –Ф + 1 = 2 –1 + 1 = 2. Кристаллизация сплава начнется при температуре, соответствующей точке С (tс). В процессе кристаллизации из жидкости Жс (состава точки С) одновременно образуются две твердые фазы – кристаллы и свинца, и сурьмы, т. е. Жс ® Pb + Sb. Такое превращение называется эвтектическим. В ходе этого превращения одновременно сосуществуют три фазы постоянного состава (Жс, Pb и Sb), и, таким образом, условие равновесного существования сплава будет: С = 2 –3 + 1 = 0 (безвариантное равновесие). Это объясняет тот факт, что эвтектическая кристаллизация происходит при постоянной температуре и выражается температурной остановкой на кривой охлаждения (горизонтальная линия С –С/, см. рисунок 6.3, б).
Эвтектическая кристаллизация осуществляется путем совместного роста кристаллов твердых фаз, образующих двухфазные эвтектические зерна. Возникающая, таким образом, характерная мелкокристаллическая двухфазная структура называется эвтектикой. В плоскости сечения шлифа невозможно увидеть взаимное переплетение кристалликов фаз, составляющих эвтектику, и эвтектическая структура имеет вид дисперсной смеси фаз. Характерная структура эвтектики приведена схематически на рисунке 6.4.
|
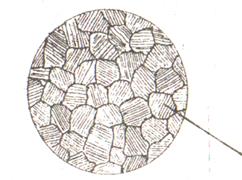
Рисунок 6.4 – Схема структуры эвтектического сплава
после завершения кристаллизации
На примере сплавов рассматриваемой системы уместно подчеркнуть, что понятия «фазовый состав» и «структура сплава» не совпадают. Так, в данном случае закристаллизовавшийся эвтектический сплав состоит из двух твердых фаз (Pb + Sb), образующих одну структурную составляющую – эвтектику Э(Pb + Sb). Фазовый состав всех сплавов данной системы после завершения кристаллизации одинаков, в то время как структура доэвтектических, заэвтектических и рассмотренного эвтектического сплавов – различна. Поэтому на рисунке 6.3, а обозначение фазового состава сплавов в твердом состоянии взято в прямоугольную рамку в отличие от обозначения их структур, приведенных без рамки.
После завершения эвтектической кристаллизации начнется дальнейшее охлаждение сплава (кривая ниже точки С/, см. рисунок 6.3, б).
Рассмотрим процесс кристаллизации заэвтектического сплава III, соответствующего составу: 60 % Sb + 40 % Pb (см. рисунок 6.3, а). При охлаждении этого сплава, например от температуры, соответствующей точке 0 (t0 = 700 °С), он имеет однофазное жидкое состояние до точки ликвидуса – температуры t1 (точки 1 на рисунке 6.3, а). Линия 0 – 1 на рисунке 7.3, б характеризует этот процесс охлаждения. Кристаллизация сплава начинается при температуре, соответствующей точке 1, с возникновения из жидкости кристаллов сурьмы, имеющих, как правило, форму дендритов. Этот процесс продолжается до температуры, соответствующей точке 2, при этом сплав состоит из двух фаз: жидкой и твердой (Ж + Sb).
При кристаллизации выделяется теплота, что приводит к замедлению охлаждения. Это отражается более пологим ходом кривой охлаждения (линия 1 – 2 на рисунке 6.3, б). В этом периоде кристаллизации в соответствии с правилом фаз число степеней свободы сплава равно единице (С = 2 – 2 + 1 = 1 – одновариантное равновесие). Поэтому кристаллизация осуществляется при снижении температуры. При каждой фиксированной температуре в температурном интервале t1 – t2 можно определить химический состав и количественное соотношение между фазами. Так, например, при температуре tа = 400 °С состав жидкой фазы описывается проекцией точки б, а состав твердой – проекцией точки в на ось концентраций (в соответствии с первым положением правила отрезков). Состав жидкой фазы: 68 % Pb + 32 % Sb (точка б/), состав твердой фазы: 100 % Sb (точка в/ ). Пользуясь вторым положением правила отрезков, можно определить также количество (массу) жидкой фазы qж и твердой фазы qSb
В соответствии с этим при tа = 400 °С:
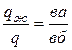 ,
, 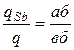 , (6.5)
, (6.5)
где а, б, в – координаты соответствующих точек по оси концентраций (например, значения концентрации Sb). В условиях данного построения точка б соответствует координате 32 % Sb, точка а – 68 % Sb, точка в – 100 % Sb.
Подставляя эти данные, получим:
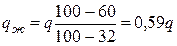 ;
; 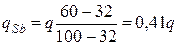 . (6.6)
. (6.6)
Это означает, что при температуре tа в сплаве содержится 59 % жидкости и 41 % выделившихся кристаллов сурьмы. Если продолжать охлаждение, нетрудно установить, что кристаллизация сурьмы будет продолжаться, при этом оставшаяся жидкость будет обедняться сурьмой.
При кристаллизации сплава в интервале t1 – t2состав жидкости будет изменяться по линии ликвидуса от точки 1 до точки С. Состав же кристаллов остается неизменным – 100 % Sb (проекция в/ – см. рисунок 6.3, а).
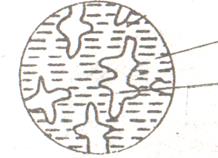
На рис. 6.5 схематически представлена двухфазная структура рассматриваемого заэвтектического сплава в температурном интервале t1 – t2,состоящая из жидкости и кристаллов сурьмы.
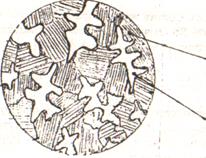
При достижении эвтектической температуры (которая соответствует линии ДСЕ – см. рисунок 6.3, а) жидкость эвтектического состава (Жс), который она приобрела в результате выделения «избыточной» сурьмы в процессе кристаллизации в интервале температур t1 – t2, кристаллизуется с образованием эвтектики Э(Pb + Sb), как было описано ранее. В итоге конечная структура будет двухфазной и состоять из первичных кристаллов сурьмы, выделившихся ранее (см. рисунок 6.5), и эвтектики (рисунок 6.6).
|
| ||||||||
| Рисунок 6.5 – Схема структуры заэвтектического сплава в интервале температур t1 – t2 | Рисунок 6.6 – Схема структуры заэвтектического сплава после завершения кристаллизации |
Процессу эвтектической кристаллизации отвечает температурная остановка 2 – 2/ на кривой охлаждения сплава (см. рисунок 6.3, б). Как уже было показано, число степеней свободы при этом С = 0. Так как при эвтектической кристаллизации сосуществуют три фазы, то в этот период сплав имеет трехфазную структуру: Ж + кристаллы Sb + Э(Pb + Sb). После завершения процесса эвтектической кристаллизации начнется обычное физическое охлаждение сплава (С = 2 – 2 + 1 = 1), что соответствует участку 2 – 3 на кривой охлаждения сплава (см. рисунок 6.3, б).
Аналогично происходит кристаллизация доэвтектических сплавов, например сплава І. Различие состоит в том, что первичными будут являться кристаллы свинца, а конечная структура сплава будет состоять из первичных кристаллов Pb и эвтектики (рисунок 6.7).
|
|

Рисунок 6.7 – Схема структуры доэвтектического сплава
после завершения кристаллизации
При этом, как уже отмечалось, все сплавы данной системы в твердом состоянии имеют один и тот же фазовый состав: Pb + Sb (механическая смесь кристаллов чистых компонентов – двухфазное состояние). Поэтому химический состав и масса фаз сплава при любой температуре в этой двухфазной области могут быть определены аналогично рассмотренному выше на основании правила отрезков.
6.4 Кристаллизация и формирование структуры ограниченных твердых растворов
На рисунке А.3 приведена одна из основных разновидностей диаграмм состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (диаграммы ІІІ рода) – диаграмма с эвтектикой. Сплавы рассматриваемой системы при взаимной растворимости компонентов после завершения кристаллизации имеют однофазное состояние и однофазную структуру: кристаллы a (твердого раствора компонента В в компоненте А) или кристаллы β (твердого раствора компонента А в компоненте В). При превышении взаимной растворимости компонентов сплавы после завершения кристаллизации будут иметь фазовый состав, представленный двумя твердыми фазами – кристаллами a- и β- твердого раствора, а также двухфазную структуру с механической смесью смешанных фаз: кристаллов твердых растворов a и β – эвтектика Э(α+ β).
Таким образом, сплавы по составу левее и правее линий предельной растворимости компонентов – линий DM и ЕN (т. е. в пределах взаимной растворимости компонентов) будут кристаллизоваться аналогично рассмотренным выше сплавам – неограниченным твердым растворам с образованием, соответственно, твердого раствора a или β.
Сплавы, находящиеся между линиями DM и ЕN (т. е. за границами предельной растворимости компонентов), кристаллизуются аналогично сплавам с практической нерастворимостью компонентов в твердом состоянии, с той разницей, что образующиеся твердые фазы представляют собой кристаллы твердых растворов, а не чистых компонентов. При этом кристаллизация начинается образованием из жидкости кристаллов твердого раствора a (у доэвтектических сплавов) или β (у заэвтектических сплавов).
В соответствии с первым положением правила отрезков состав кристаллов в интервале кристаллизации определяется точками пересечения коноды с линией солидуса, состав жидкости – точками пересечения коноды с линией ликвидуса.
Таким образом, при охлаждении до эвтектической температуры (соответствующей линии DСЕ) кристаллы достигают предельной концентрации (точка D или Е соответственно), а жидкость получит эвтектический состав (точка С). В этих условиях при постоянной температуре (соответствующей линии DСЕ) осуществляется эвтектическая кристаллизация с образованием эвтектики:
ЖC ® aD + βE.(6.7)
В итоге после завершения кристаллизации сплавов структура будет двухфазной и состоять из первичных кристаллов твердых растворов a или β и эвтектики Э(a + β).
6.5 Кристаллизация и формирование структуры сплавов с устойчивым химическим соединением
Устойчивым называют химическое соединение, которое при нагреве до плавления не разлагается. Устойчивое соединение в системе сплавов играет роль компонента, который с элементами А и В, образующими данную систему, может иметь различный тип взаимодействия. Этому соответствуют различные виды диаграмм состояния с устойчивым химическим соединением (диаграммы IV рода).
На рисунке А.4 приведена диаграмма состояния сплавов, компоненты которых образуют устойчивое химическое соединение типа AnBm, при этом соединение и чистые компоненты не образуют в твердом состоянии растворов (т. е. не обладают в твердом состоянии взаимной растворимостью). Эту диаграмму можно разделить на две части по вертикальной линии, соответствующей химическому соединению. Одна часть диаграммы характеризует сплавы, образуемые компонентом А и химическим соединением (область диаграммы А - AnBm), вторая – компонентом В и химическим соединением (область AnBm - В). При этом каждую часть диаграммы можно изучать отдельно. Кристаллизация сплавов в обеих частях рассматриваемой диаграммы происходит аналогично кристаллизации сплавов с практической нерастворимостью компонентов в твердом состоянии. Отличие состоит только в том, что кроме выделения кристаллов чистых компонентов А и В по линиям АЕ1 и Е2В происходит также образование химического соединения по линиям Е1С и СЕ2. При этом в системе сплавов А - AnBm охлаждение до эвтектической температуры приводит к образованию эвтектики, представляющей собой мелкодисперсную смесь кристаллов А и химического соединения:
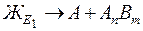 . (6.8)
. (6.8)
Соответственно, в системе сплавов AnBm - В при эвтектической температуре образуется эвтектика, состоящая из кристаллов химического соединения и компонента В:
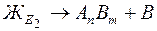 . (6.9)
. (6.9)
Таким образом, в системе А - AnBm фазовый состав сплавов после завершения кристаллизации будет представлен двумя твердыми фазами: кристаллами компонента А и химического соединения (А + AnBm), конечная структура будет состоять из первичных кристаллов А (у доэвтектических сплавов) или первичных кристаллов AnBm (у заэвтектических сплавов) и эвтектики Э(А + AnBm). В системе AnBm - В фазовый состав сплавов в твердом состоянии AnBm + В, конечная структура состоит из первичных кристаллов AnBm (у доэвтектических сплавов) или первичных кристаллов В (у заэвтектических сплавов) и эвтектики Э(AnBm + В).
Дата добавления: 2016-11-04; просмотров: 5363;











