Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы.
Основные понятия термодинамики.
В отличие от МКТ термодинамика изучает макроскопические свойства тел и явлений природы, не интересуясь их микроскопической картиной. Не вводя в рассмотрение атомы и молекулы, не входя в микроскопическое рассмотрение процессов, термодинамика позволяет делать целый ряд выводов относительно их протекания.
В основе термодинамики лежит несколько фундаментальных законов (называемых началами термодинамики), установленных на основании обобщения большой совокупности опытных фактов.
Подходя к рассмотрению изменений состояния вещества с различных точек зрения, термодинамика и МКТ взаимно дополняют друг друга, образуя по существу одно целое.
Термодинамика - раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия и процессы перехода между этими состояниями.
Термодинамический метод основан на введении понятия энергии и рассматривает процессы с энергетической точки зрения, т. е. основываясь на законе сохранения энергии и превращении её из одного вида в другой.
Термодинамическая система - совокупность тел, которые могут обмениваться энергией друг с другом и с внешней средой.
Для описания термодинамической системы вводятся физические величины, которые называются термодинамическими параметрами или параметрами состояния системы : р,V,T.
Физические величины, характеризующие состояние термодинамической системы, называются термодинамическими параметрами.
Давлением называется физическая величина, численно равная силе, действующей на единицу площади поверхности тела по направлению нормали к этой поверхности: 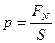 ,
, 
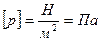 .
.
Нормальное атмосферное давление 1атм=105 Па.
Абсолютная температура - мера средней кинетической энергии молекул.
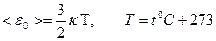 .
.
Состояния, в которых находится термодинамическая система, могут быть различными.
Если один из параметров в различных точках системы неодинаков и изменяется с течением времени, то такое состояние системы называется неравновесным.
Если все термодинамические параметры остаются постоянными во всех точках системы сколь угодно долго, то такое состояние называется равновесным, или состоянием термодинамического равновесия.
Любая замкнутая система по истечении определенного времени самопроизвольно переходит в равновесное состояние.
Всякое изменение состояния системы, связанное с изменением хотя бы одного из её параметров, называется термодинамическим процессом. Процесс, в котором каждое последующее состояние бесконечно мало отличается от предыдущего, т.е. представляет собой последовательность равновесных состояний, называется равновесным.
Очевидно, что все равновесные процессы протекают бесконечно медленно.
Равновесный процесс может быть проведен в обратном направлении, причем система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. Поэтому равновесные процессы называют обратимыми.
Процесс, при котором система после ряда изменений возвращается в исходное состояние, называется круговым процессом или циклом.
Все количественные выводы термодинамики строго применимы только к равновесным состояниям и обратимым процессам.
Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы.
Число степеней свободы – число независимых координат, полностью определяющих положение системы в пространстве. Молекулу одноатомного газа можно рассматривать как материальную точку, обладающую тремя степенями свободы поступательного движения.
Молекула двухатомного газа – совокупность двух материальных точек (атомов), жестко связанных недеформируемой связью; кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения (рис. 1).
Трех- и многоатомные молекулы имеют 3+3=6 степеней свободы (рис. 1).
Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул следует учитывать и степени свободы колебательного движения (кроме одноатомных).
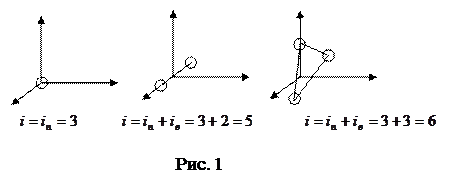 |
Как было показано, средняя кинетическая энергия поступательного движения молекулы равна
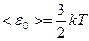 .
.
Поскольку каждая молекула всегда обладает тремя степенями свободы поступательного движения и не одна из этих степеней не имеет преимущества перед другими, на каждую степень свободы поступательного движения приходится энергия, равная
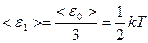 .
.
Т.к. движение молекул является хаотическим, то любое движение – поступательное и вращательное - является равновероятным. Из этого предположения следует один из важнейших законов статистической физики – закон Больцмана о равномерном распределении энергии по степеням свободы молекул: на каждую степень свободы поступательного и вращательного движения молекулы приходится в среднем одинаковая кинетическая энергия, равная 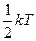 .
.
Для реальных молекул на каждую колебательную степень свободы приходится как кинетическая, так и потенциальная энергия.
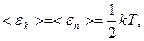 поэтому
поэтому 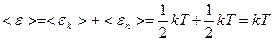 .
.
Таким образом, средняя кинетическая энергия молекулы
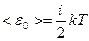 ,
,
где i – число степеней свободы молекулы.
Дата добавления: 2016-11-04; просмотров: 7851;











