Внутренняя энергия и работа газа при расширении. I закон термодинамики.
Внутренняя энергия термодинамической системы - энергия движения и энергия взаимодействия микрочастиц системы (молекул, атомов, электронов, ядер и т.д.).
Т.к. потенциальная энергия молекул идеального газа равна нулю, внутренняя энергия идеального газа равна суммарной кинетической энергии всех его молекул:
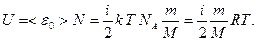
Изменение внутренней энергии:
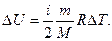
Внутреннюю энергию можно изменить 2-мя способами:
1) совершив работу;
2) при теплопередаче.
Теплопередачей называют совокупность процессов между молекулами вещества, приводящих к передаче энергии.
Изменение внутренней энергии системы при теплопередаче характеризуется количеством теплоты. Количество теплоты - мера изменения внутренней энергии при теплопередаче.
[Q]=Дж.
 Работа и теплота связаны друг с другом. Опыты Джоуля и Роберта Майера показали, что работа и теплота переходят друг в друга в эквивалентных количествах. Однако теплота и работа неравноценны: работа может полностью перейти в теплоту, а теплота полностью перейти в работу не может. Причины этого объясняются началами термодинамики.
Работа и теплота связаны друг с другом. Опыты Джоуля и Роберта Майера показали, что работа и теплота переходят друг в друга в эквивалентных количествах. Однако теплота и работа неравноценны: работа может полностью перейти в теплоту, а теплота полностью перейти в работу не может. Причины этого объясняются началами термодинамики.
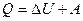 - I закон термодинамики
- I закон термодинамики
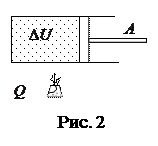
Количество теплоты, переданное системе, идет на увеличение её внутренней энергии и совершение системой работы против внешних сил (рис. 2).
Первое начало термодинамики подтверждается как теми опытами, на основании которых установлена эквивалентность между Q и A,так и совпадением выводов из него с наблюдаемыми фактами. Оно является выражением закона сохранения и превращения энергии.
Установление первого начала термодинамики позволило объяснить все неудачи, связанные с попыткой создания машины, которая могла бы совершать работу, не получая энергии извне (перпетуум мобиле, или вечный двигатель первого рода). После формулировки первого закона термодинамики стало ясно, что если система не получает извне тепла или другой энергии, то Q= и DU=, поэтому и A= Таким образом, создать вечный двигатель первого рода невозможно. Это утверждение является одной из формулировок первого начала термодинамики.
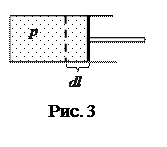
Работа, совершаемая системой при изменении объема, определяется следующим образом.
Пусть газ заключен в некотором цилиндре (рис. 3); найдем его работу при расширении.
Элементарная работа на пути 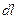
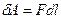 ,
,
где F - сила, с которой газ давит на поршень.
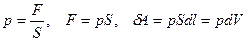 .
.
Работа, совершаемая системой при конечном изменении объёма от V1 до V2, находится интегрированием:
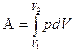
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р,V.
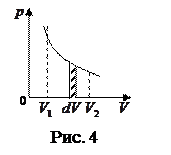 При увеличении объёма на dV совершаемая газом работа
При увеличении объёма на dV совершаемая газом работа 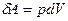 определяется заштрихованной площадью.
определяется заштрихованной площадью.
Поэтому полная работа, совершаемая при расширении от V1 до V2 определяется площадью, ограниченной осью абсцисс, кривой 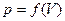 и прямыми
и прямыми 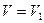 и
и 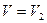 .
.
При p=const
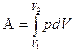 = p(V2-V1)=pDV
= p(V2-V1)=pDV
3. Теплоемкость
Первые экспериментальные измерения теплоты были выполнены в 1750 - 1751 г. в Петербурге Г.В. Рихманом. Им было установлено, что количество теплоты Q, переданное телу или отнятое у него, прямо пропорционально его массе и изменению температуры:
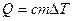 .
.
Коэффициент пропорциональности получил название удельной теплоёмкости.
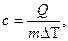
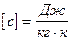 .
.
Удельной теплоемкостью вещества называется физическая величина, равная количеству теплоты, необходимому для нагревания единицы массы вещества на один градус.
Теплоёмкостью какого-либо тела называется величина, равная количеству теплоты, необходимой для нагревания этого тела на один градус.
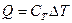 ,
, 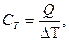
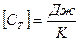 .
.
Молярной теплоёмкостью вещества называется величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 градус.
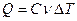 , C=
, C= 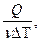
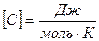
Поскольку
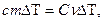 или
или 
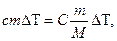
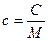 ,
, 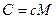 .
.
Величина теплоёмкости зависит от условий нагревания.
Различают теплоёмкости при постоянном объёме и при постоянном давлении:
сV и CV при V=const
сp и Cp при p=const
Найдём связь CV и Cp
При 
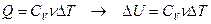
Т. к. 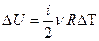 ,
, 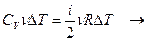
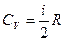
При 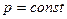
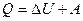
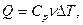
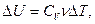
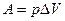
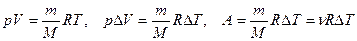
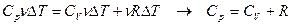 - уравнение Майера
- уравнение Майера
Поскольку CV= 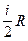 ,
,
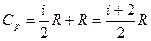
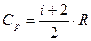
Величина 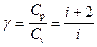
представляет собой характерную для каждого газа величину, которая зависит от числа атомов в молекуле газа.
Для одноатомного газа i = 3 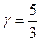 ,
,
для двухатомного i = 5 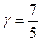 ,
,
для многоатомного i = 6 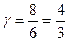 .
.
Дата добавления: 2016-11-04; просмотров: 2984;











