Аморфно-кристаллическая структура
Многие природные и искусственные каменные материалы в своем составе содержат и кристаллические, и аморфные фазы. Соотношение между объемами кристаллической и аморфной фазами, а также их взаимное расположение оказывают огромное влияние на свойства материалов, имеющих такую структуру. Типичными представителями подобных материалов являются ситаллы, фарфор и другие керамические материалы. Свойства некоторых материалов, имеющих амрфно-кристаллическую структуру приведены в табл. 3.2.
Таблица 3.2. Свойства материалов с аморфно-кристаллической структурой
| Наименование материала | Содержание стеклофазы, % | Плотность, г/см3 | Прочность, МПа | Водопоглощение, % |
| Фарфор | 40-60 | 2.3-2.5 | < 0,5 | |
| Плитка керамическая | 10-30 | 2.0-2,2 | 20-50 | 1,5-4,0 |
| Каменное литье | < 5 | 2,6-3,0 | 200-250 | |
| Ситаллы | 5-10 | 2,3-2,5 | ~ 500 |
Все представленные в таблице материалы обладают аморфно-кристаллической структурой, содержат кристаллы и стекловидную фазы. Как видно из приведенных данных, содержание фаз не оказывает решающего влияния на свойства материалов. Ситаллы и каменное литье имеют небольшое количество стеклофазы по сравнения с керамической плиткой и, видимо, поэтому имеют более высокую (в 10-20 раз большую) прочность, чем плитка. Однако, фарфор содержит стекловидную фазу в большем размере, чем ситаллы и каменное литье, а прочность имеет большую, чем эти материалы. Несомненно, свойства материалов с аморфно-кристаллической структурой зависят не только от количества этих фаз, но и от их качества, и взаимного расположения друг относительно друга – от микро- и макроструктуры.
Изоморфизм (от изо... и греч. morphé — вид, форма), свойство веществ, аналогичных по химическому составу, кристаллизоваться в одинаковых формах. Впервые было показано немецким минералогом Э. Мичерлихом (1819) на примере KH2PO4, KH2AsO4 и NH4H2PO4. Вскоре было обнаружено, что первые два вещества образуют смешанные кристаллы ("твёрдые растворы") с единой внешней формой при произвольном отношении P : As, в то время как в других парах аналогичные замещения ограничены количественно. Первый случай отвечает понятию "совершенный И.", а второй — понятию "ограниченный", или "несовершенный И.". Если количества замещающего элемента невелики, но существенны для поисковика минералога-геохимика, то говорят об эндокриптии (по А. Е. Ферсману, замещение узлов кристаллических решёток ионами того же знака, но разных свойств и мало сходных величин). Требование родственности взаимозамещающихся элементов при И. первоначально понималось как чисто химическая близость, и первые ряды изоморфных элементов (В. И. Вернадский; см. Геохимия) повторяли группы менделеевской системы с некоторыми дополнениями известных из аналитической химии групп, например Al, Cr, Fe. Выяснилось, однако, что невозможно, например, замещение Na на Rb; твёрдые растворы К- и Na-coeдинений энергично распадаются при низких температурах (распад К-, Na-полевых шпатов). Решающим для объяснения этих явлений при И. было введение (В. М. Гольдшмидт, 1926) представления об ионных радиусах, близость которых стала одним из основных условий И. У полновалентных катионов (Na1+, Mg2+,..., S6+,...) ионный радиус r быстро уменьшается вдоль строки менделеевской системы и резко увеличивается вдоль вертикали на величины, большие чем 10—15% (экспериментальный предел для возможности И.). В результате изоморфными оказываются элементы, соседние по диагоналям (Д. И. Менделеев, А. Е. Ферсман), например ряд Na—Ca (rNa = 0,98 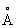 , rCa = 1,02
, rCa = 1,02 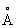 ), который представлен в плагиоклазах, составляющих более 50% земной коры. Эта диагональ продолжается к редкоземельным элементам, и именно благодаря постоянному изоморфному вхождению редкоземельных элементов в Са-минералы эти элементы долгое время считались двухвалентными (только Д. И. Менделеев перевёл их в III группу). Другие характерные "диагональные" пары: Li—Mg, Mo—Re, Be—Al и т. д. Если, однако, строки менделеевской системы длинные (с 32 клетками), то описанное сокращение радиусов вдоль строки заходит так далеко, что катионы одной и той же менделеевской группы выравнивают свои радиусы, т. е. у элементов одной группы, разделённых по вертикали "лантанидным сжатием", И. становится весьма ярко выраженным. Это относится к парам Ba—Ra, Zr—Hf, Nb—Ta и др. Но как ни близки между собой Nb и Ta, их легче отделить друг от друга, чем отделить от Ti, с которым они связаны диагональным изоморфизмом. Таким образом, изовалентный И. представлен намного скромнее (во всяком случае количественно), чем гетеровалентный И. Возникает вопрос, как компенсировать в структуре кристалла изменение валентности, например её увеличение при И. Ca2+ ® Na1+. Решение просто, когда элемент на середине диагонали замещается двумя соседними по разные стороны, например
), который представлен в плагиоклазах, составляющих более 50% земной коры. Эта диагональ продолжается к редкоземельным элементам, и именно благодаря постоянному изоморфному вхождению редкоземельных элементов в Са-минералы эти элементы долгое время считались двухвалентными (только Д. И. Менделеев перевёл их в III группу). Другие характерные "диагональные" пары: Li—Mg, Mo—Re, Be—Al и т. д. Если, однако, строки менделеевской системы длинные (с 32 клетками), то описанное сокращение радиусов вдоль строки заходит так далеко, что катионы одной и той же менделеевской группы выравнивают свои радиусы, т. е. у элементов одной группы, разделённых по вертикали "лантанидным сжатием", И. становится весьма ярко выраженным. Это относится к парам Ba—Ra, Zr—Hf, Nb—Ta и др. Но как ни близки между собой Nb и Ta, их легче отделить друг от друга, чем отделить от Ti, с которым они связаны диагональным изоморфизмом. Таким образом, изовалентный И. представлен намного скромнее (во всяком случае количественно), чем гетеровалентный И. Возникает вопрос, как компенсировать в структуре кристалла изменение валентности, например её увеличение при И. Ca2+ ® Na1+. Решение просто, когда элемент на середине диагонали замещается двумя соседними по разные стороны, например 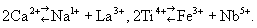
Особенно часто компенсация достигается за счёт одновременного гетеровалентного И. "в обратном направлении". В плагиоклазах замена Ca2+ на Na1+ сопровождается параллельно замещением Al3+ на Si4+: 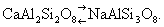 Возникает вопрос, как быть с радиусами Si4+(0,39
Возникает вопрос, как быть с радиусами Si4+(0,39 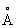 ) и Al3+(0,57
) и Al3+(0,57 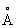 ), различающимися на 46%. Значительная разница между радиусами не является препятствием при гетеровалентном И., так как в анионной, более отрицательной части соединений заменяют друг друга не атомы, а тетраэдрические группы, например SiO4-4 и AlO5-4, в которых эффективные расстояния Si—О и Al—О (1,72 и 1,90
), различающимися на 46%. Значительная разница между радиусами не является препятствием при гетеровалентном И., так как в анионной, более отрицательной части соединений заменяют друг друга не атомы, а тетраэдрические группы, например SiO4-4 и AlO5-4, в которых эффективные расстояния Si—О и Al—О (1,72 и 1,90 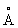 ) разнятся всего лишь на 9%. Литий, например, в более "катионной" форме, имеющий координацию 6, замещает по правилу диагонали Mg (в биотитах); находясь же среди четырёх О, способен заменить Be в берилле: [LiO4] ® [BeO4]. Разобранные закономерности касаются в основном случаев изоморфных замещений между полновалентными ионами типа "благородных газов" в соединениях, которые подчиняются законам элементарной энергетики (формулы А. Ф. Капустинского). Для переходных металлов, образующих соединения существенно ковалентного типа и стремящихся создать возле себя за счёт донорско-акцепторного механизма группы электронов 8, 13—14, 18, закономерности И. иные. Так, в случае пары элементов с одним и тем же радиусом, например Zn2+ и Fe2+, мы встречаемся с односторонним И. Цинк в своём главном соединении ZnS (сфалерит) допускает вхождение до 20% Fe, но Zn совершенно отсутствует в FeS. Причина лежит в возможности для Fe иметь как шестерную координацию, так и четверную, тогда как для Zn всегда в сульфидах — четверная координация.
) разнятся всего лишь на 9%. Литий, например, в более "катионной" форме, имеющий координацию 6, замещает по правилу диагонали Mg (в биотитах); находясь же среди четырёх О, способен заменить Be в берилле: [LiO4] ® [BeO4]. Разобранные закономерности касаются в основном случаев изоморфных замещений между полновалентными ионами типа "благородных газов" в соединениях, которые подчиняются законам элементарной энергетики (формулы А. Ф. Капустинского). Для переходных металлов, образующих соединения существенно ковалентного типа и стремящихся создать возле себя за счёт донорско-акцепторного механизма группы электронов 8, 13—14, 18, закономерности И. иные. Так, в случае пары элементов с одним и тем же радиусом, например Zn2+ и Fe2+, мы встречаемся с односторонним И. Цинк в своём главном соединении ZnS (сфалерит) допускает вхождение до 20% Fe, но Zn совершенно отсутствует в FeS. Причина лежит в возможности для Fe иметь как шестерную координацию, так и четверную, тогда как для Zn всегда в сульфидах — четверная координация.
И. очень распространён в природе. Широким развитием изоморфных замещений объясняется сложный химический состав большинства минералов, особенно из группы силикатов. Примером совершенного И. являются минералы переменного состава, дающие непрерывные ряды: плагиоклазы, скаполиты, вольфрамиты и др. Законы изоморфного замещения объясняют распределение редких элементов, находящихся в виде примесей в горных породах и рудах. Так, значительная часть иттрия и редких земель находится в апатите, сфене и флюорите, изоморфно замещая кальций; трёхвалентный ванадий замещает в магнетите окисное железо; селен — серу в пирите и т. д. Учение об И. является основой для изучения форм нахождения элементов в горных породах и процессов концентрации и рассеяния химических элементов в земной коре
ПОЛИМОРФИЗМ (от греч. polymorphos-многообразный), способность твердых в-в и жидких кристаллов существовать в двух или неск. формах с разл. кристаллич. структурой и св-вами при одном и том же хим. составе. Такие формы наз. полиморфными модификациями. Взаимные превращения полиморфных модификаций наз. полиморфными переходами. П. простых в-в принято называть аллотропией, но понятие П. не относят к некристаллич. аллотропным формам (таким, как газообразные О2 и О3). П. широко распространен в самых разнообразных классах в-в. Типичный пример полиморфных форм - модификации углерода: алмаз и лонсдейлит, в к-рых атомы объединены ковалентными связями в пространств. каркас; графит, в структуре к-рого имеются слои наиб. прочно связанных атомов; карбин, построенный из бесконечных линейных цепочек. Эти модификации резко различаются по св-вам. В случае молекулярных кристаллов (в частности, орг. в-в) П. проявляется в разл. упаковке молекул, имеющих одинаковую структурную ф-лу; здесь переход от одной модификации к другой осуществляется без разрыва ковалентных связей, но конформация молекул может существенно меняться (конформационный П.).
Известны также полиморфные модификации, отличающиеся степенью упорядоченности. Напр., в кристаллич. структуре высокотемпературной формы бензотиофена (существующей выше -11 °С) молекулы статистически ориентированы четырьмя разл. способами, в то время как в структуре низкотемпературной формы все молекулы ориентированы одним определенным образом. Особый вид П. связан со своб. вращением молекул или атомных группировок. Так, в кристаллах NH4NO3 при 84°С происходит полиморфный переход, обусловленный возникновением вращения ионов 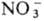 вокруг оси третьего порядка; в интервале от 125°С до т-ры плавления ионы
вокруг оси третьего порядка; в интервале от 125°С до т-ры плавления ионы 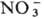 и
и 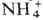 вращаются вокруг центров масс, эффективно приобретая сферич. форму.
вращаются вокруг центров масс, эффективно приобретая сферич. форму.
Частный случай П.-политипизм (политипия). Политип-ные модификации представляют собой разл. варианты наложения одинаковых двухмерных структурных фрагментов; при этом два параметра решетки неизменны, а третий меняется, оставаясь кратным постоянной величине. Напр., для SiC известно более 40 политипных модификаций (политипов). Политипия наблюдается также у ZnS, CdI2, глинистых минералов и др.
С точки зрения термодинамики, полиморфные модификации обычно являются фазами, причем различают два типа П. Если каждая из двух модификаций устойчива в определенном интервале т-р и давлений, эти фазы наз. энантио-тропными. В принципе одна энантиотропная фаза должна переходить в другую при вполне определенных условиях, и переход должен осуществляться в любом направлении. Однако энантиотропные превращения м. б. настолько кинетически заторможены, что метастабильная модификация существует неограниченно долго. Напр., алмаз и мн. др. минералы метастабильны при атм. давлении и комнатной т-ре. Вместе с тем, нек-рые полиморфные переходы протекают настолько быстро, что можно визуально наблюдать растрескивание кристалла или движение границы раздела фаз.
Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам — так называемых аллотропических модификаций или аллотропических форм.
- Водород может существовать в двух формах (модификациях) — в виде орто- и пара-водорода. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны).
- О2 — кислород и О3 — озон. Кислород бесцветен, не имеет запаха, озон же пахуч, имеет бледно-фиолетовый цвет, он более бактерициден.
- Красный фосфор и белый фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, красный фосфор неядовит, не светится в темноте, сам по себе не воспламеняется.
- Множество модификаций углерода, например: нанотрубка, лонсдейлит, алмаз, графит, фуллерен, карбин и графен.
- У серы существует 3 аллотропных модификации: ромбическая, моноклинная и пластическая.
Аллотропия может быть результатом образования молекул с различным числом атомов (например, атомарный кислород O, молекулярный кислород O2 и озон O3) или образования различных кристаллических форм (например, графит и алмаз) — в этом случае аллотропия — частный случай полиморфизма).
Дата добавления: 2021-02-19; просмотров: 584;











