Плотнейшие упаковки частиц в кристаллах.
|
Для устойчивости кристаллической структуры должно соблюдаться одно важное условие:
¯ Постройка из атомов ионов или молекул должна обладать минимальной внутренне энергией.
Наименьшей внутренней энергией обладают структуры, в которых частицы максимально сближены друг с другом или иными словами плотно упакованы. Если взять шарики одинакового размера, то наибольшее количество шариков можно уместить в данный объем, если расстояния между соседними частицами будут равны удвоенному радиусу частиц.
¯ Способ заполнения пространства шарами одинакового радиуса, при котором расстояния между центрами частиц минимальны, называются плотнейшими упаковками.
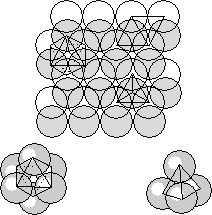
Еще И. Кеплером было показано, что если круглые горошины встряхнуть на плоском блюдце, они образуют мотив, при котором центры горошин расположены в вершинах равносторонних треугольников.
Несмотря на то, что шары максимально плотно прилегают друг к другу между ними все же остаются треугольные пустоты -«лунки». Следующий слой по условиям плотнейшей упаковки должен помещаться в лунках предыдущего. Однако, мы не можем разместить шары следующего слоя во все лунках, так как их в 2 раза больше чем частиц. Заполненной окажется только половина. Теперь между шарами разных слоев определились объемные пустоты. Из рисунка видно, что пустоты относятся к двум различным типам. Одни сквозные и окружены 6 шариками, а другие несквозные и окружены 4 шариками. При ближайшем рассмотрении видно, что центры шаров, окружающих пустоты первого типа расположены по вершинам октаэдра (октаэдрические пустоты), а шаров, окружающих пустоты второго типа – по вершинам тетраэдра (тетраэдрические пустоты). Тетраэдрические пустоты имеют меньшие размеры, чем октаэдрические.
¯ Если размер частицы Rp, то Rt » 0,22Rp, а Ro » 0,41Rp
Типы плотнейших упаковок.
Как уже было показано, каждый последующий слой ПУ располагается в лунках предыдущего. Тип упаковки будет определяться тем, как заполняются третий и последующие слои ПУ. Частицы третьего слоя могут быть размещены двумя способами. Первый случай, когда частицы третьего слоя заполняют лунки второго типа, а второго слоя – лунки первого типа. В результате оказывается, что частицы третьего слоя располагаются над частицами первого и являются его эквивалентом. Тогда упаковка будет состоять из двух неэквивалентных типов слоев. Обозначив соответствующие слои как А и В, формулу такой упаковки можно записать |AB|AB|... и так далее. В этом случае ПУ упаковка имеет единственную ось высшего 6 порядка, ориентированную перпендикулярно слоям. А в идеальном варианте отношение параметров a/c = 1.633. Здесь же следует обратить внимание, что шар третьего слоя располагается над тетраэдрической пустотой между вторым и первым слоями, а октаэдрические пустоты образуют сквозной канал параллельный оси с. Рассмотренная двухслойная упаковка называется плотнейшей гексагональной или ПГУ. Примерами веществ, образующих ПГУ являются структуры Mg, иридосмина (Ir,Os) и осмирида (Os,Ir).

|
Второй случай, когда шары третьего слоя располагаются в лунках того же типа, что и частицы второго слоя. В такой упаковке сквозные каналы отсутствуют, и она имеет 3 оси 4 порядка и 4 оси 3 порядка. Третий слой по своей позиции уже не эквивалентен первому и упаковка состоит из трех слоев |ABC|ABC|.... Соотношение параметров вдоль оси 3 порядка уже будет a/c = 1.633+  1.633. Шары третьего слоя располагаются над октаэдрическими пустотами между первым и вторым слоями. Легко заметить, что шары трехслойной плотнейшей упаковки располагаются в соответствии с F-ячейкой Бравэ. Эта трехслойная упаковка называется плотнейшей кубической или ПКУ. Примерами веществ с ПКУ частиц могут служить самородные Cu, Pt, Ag, Au.
1.633. Шары третьего слоя располагаются над октаэдрическими пустотами между первым и вторым слоями. Легко заметить, что шары трехслойной плотнейшей упаковки располагаются в соответствии с F-ячейкой Бравэ. Эта трехслойная упаковка называется плотнейшей кубической или ПКУ. Примерами веществ с ПКУ частиц могут служить самородные Cu, Pt, Ag, Au.
ПКУ и ПГУ являются основными типами ПУ, так как степень заполнения объема частицами составляет 74,05%, т.е. 3/4 объема занимают шары. Возможны и другие типы ПУ, представленные комбинацией 4, 5, 6 и даже 80 слоев. Так как мы можем расположить шары последующих слоев только двумя способами (по количеству лунок), то в пакетах из более чем трех слоев буду два эквивалентных, например как в ПУ в структуре топаза -- |ABAC|ABAC|... .
Пустоты плотнейших упаковок.
|
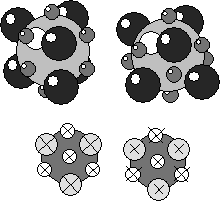
Пустоты играют важную роль в понимании построения структур сложных кристаллов на базе ПУ. В пустотах могут располагаться частицы другого сорта обладающие меньшим размером. Иными словами, не нарушая ПУ можно построить структуры соединений, состоящих частиц разного сорта. Расположение пустот и их количество строго закономерны. Различие между ПГУ и ПКУ в относительном расположении пустот показано на рисунке. В ПГУ тетраэдрические пустоты лежат над тетраэдрическими, а октаэдрические – над октаэдрическими. В ПКУ тетраэдрические пустоты расположены над октаэдрическими. В обеих упаковках над и под частицей находятся тетраэдрические пустоты. Таким образом, одну частицу любой ПУ окружают 6 октаэдрических и 8 тетраэдрических пустот. Так как каждая пустота формируется 6 или 4 частицами, легко посчитать, что на одну частицу ПУ приходится (  ) = 1 октаэдрическая пустота и (
) = 1 октаэдрическая пустота и ( 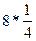 ) = 2 тетраэдрические пустоты. Таким образом
) = 2 тетраэдрические пустоты. Таким образом
¯ В структурах построенных на базе ПУ на каждую частицу, образующую ПУ может приходиться максимум 1 частица, занимающая октаэдрическую пустоту и 2 частицы, занимающие тетраэдрические пустоты.
Часто встречаются структуры, в которых только часть пустот того или иного типа заняты частицами других сортов.
Координационные числа и координационные многогранники (полиэдры).
В структурах кристаллов частицы окружены другими частицами, образуя с ними различные химические связи. Ясно, что непосредственная связь возникает только между ближайшими соседними частицами. С удалением друг от друга связь ослабевает и исчезает совсем. Описание структур кристалла невозможно без учета влияния ближайших соседей.
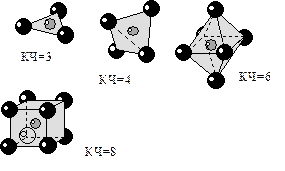
¯ Число ближайших соседей, окружающих данную частицу в стркутурах кристаллов называется координационным числом.
|
При рассмотрении гомоатомных структур, например золота или алмаза берут одноименные частицы, а при рассмотрении гетероатомных структур – частицы разного знака. В зависимости от количества частицы образуют группировки различной формы. Так для КЧ=3 частицы будут занимать вершины треугольника и группировка будет иметь форму треугольника, при КЧ=4 – тетраэдра, КЧ=6 – октаэдра, КЧ=8 – куба и так далее.
¯ Условный многогранник, в центре которого находится частица, а вершины представлены ее координационным окружением называют координационным полиэдром.
Используя понятия решетки Бравэ, плотнейшей упаковки и координационных чисел, мы имеем возможность представлять структуры различных кристаллических веществ.
Рассмотрим некоторые простейшие типы кристаллических структур минералов.
|
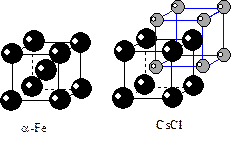
1) Структура a-железа, a-Fe
Структура феррита построена на базе I кубической решетки Бравэ. КЧFe=8. Очевидно, что координационный полиэдр – куб. Аналогичную структуру имеет вольфрам.
2) Структура CsCl. Структуру этого соединения можно представить в виде Р-решетки ионов Cl, центрированной ионом Cs. Однако в этом случае мы должны рассматривать структуру CsCl на базе двух P-решеток Cs и Cl, вдвинутых друг в друга на половину телесной диагонали. КЧCs=8, КЧCl=8. Координационные многогранники обоих элементов кубы.
|
|
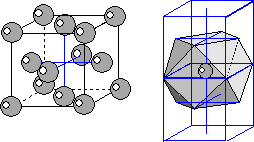
3) Структуры самородных Cu, Ag, Au, Pt. В основе структур этих самородных металлов лежит F-кубическая решетка Бравэ. Однако, учитывая, что все частицы имеют одинаковый размер, структуры этих минералов следует рассматривать как ПКУ. Совместив две ЭЯ видим, что один атом металла окружен 12 соседними атомами, это максимальное возможное количество координационных соседей. Координационный полиэдр имеет форму кубоктаэдра. КЧ=12.
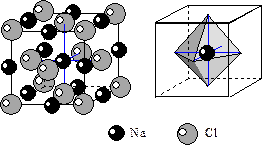
4) Структура галита NaCl. Строится на базе F-решеток Na и Cl, вдвинутых друг в друга на 1/2 диагонали. Разница ионных радиусов Na и Cl настолько велика, что Cl образует ПКУ, а Na заполняет октаэдрические пустоты. Из формулы видно, что Na занимает все октаэдрические пустоты. КЧNa=6, КЧCl=6. Координационные полиэдры –октаэдры.
|
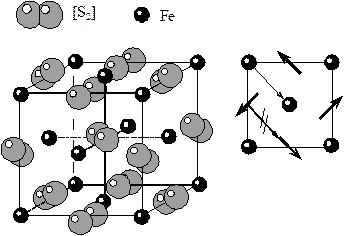
5) Структура пирита FeS2. Структура пирита производная от структуры галита. Только вместо Na необходимо поместить гантельки серы, а вместо Cl – ионы Fe. В структуре пирита присутствует необычный элемент – гантелевидная пара атомов серы. Гантели серы не имеют сферической симметрии и ориентированы строго определенным образом, под углом к ребрам решетки. В результате теряется диагональная трансляция и приходится рассматривать структуру пирита на базе Р - решетки Бравэ. Более того, расположение гантелей серы приводит к исчезновению диагональных плоскостей симметрии, что понижает симметрию минерала с планаксиальной у галита до центральной у пирита. КЧFe=6. В качестве вершин полиэдра рассматриваются центры тяжести гантелей.
|
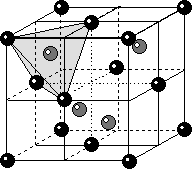
6) Структура алмаза С. Строится на базе F-решетки Бравэ. Несмотря на эквивалентоность химических свойств частиц в структуре алмаза присутствует два сорта атомов углерода. Первый располагается в узлах гранецентрированной решетки, образуя мотив ПКУ, а второй занимает половину тетраэдрических пустот. Частицы одинакового размера не могут слагать ПУ и располагаться в ее пустотах, поэтому структура алмаза построена по мотиву ПКУ, но не является ей. КЧС=4. Координационный полиэдр тетраэдр. Наличие частиц, расположенных на 1/4 базовой трансляции обуславливает наличие координатных ПСО типа d. Федоровская группа Fd3m.
|
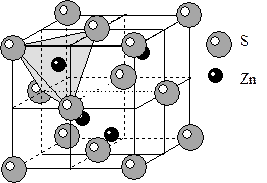
7) Структура сфалерита ZnS. Так же как и у структуры галита из-за разницы размеров ионов S и Zn сера слагает ПКУ, в тетраэдрических пустотах которой расположены атомы цинка. Из формулы понятно, что цинк занимает только половину тетраэдрических пустот, а остальные остаются незанятыми. КЧZn=4, КЧS=4. Координационные полиэдры тетраэдры. Так как частицы в структуре двух сортов, отсутствуют координатные плоскости скользящего отражения типа d, имеющиеся в аналогичной структуре алмаза, что приводит к понижению симметрии до планального вида кубической сингонии. Федоровская группа F 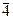 3m.
3m.
|
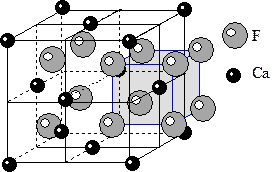
8) Структура типа флюорита CaF2. В отличие от рассмотренных структур соотношение радиусов катиона и аниона (RCa=1.06Е, RF=1.33Е) не позволяет расположить анионы в плотнейшую упаковку. Однако такое соотношение радиусов позволяет нам рассматривать ионы Ca расположенные по мотиву плотнейшей упаковки или в соответствии с F - решеткой Бравэ, все тетраэдрические пустоты которой заняты ионами F. То есть противоположно тому, как мы рассматривали все предыдущие структуры. Благодаря этой возможности структуры типа флюорита называются антиструктурами. КЧCa=8, КЧF=4. Соответственно КП для фтора – тетраэдр, а для кальция – куб. Структуру типа флюорита имеет минерал уранинит (UO2), также содержащий катион очень большого радиуса.

|
Рассмотренные структуры строились, так или иначе, в соответствии ПКУ или кубическими ячейками. Теперь перейдем к структурам, в основе которых лежат ПГУ или плотнейшая гексагональная упаковка.
9) Структура Mg. Строится на базе ПГУ. Как и для всех ПУ КЧ атомов равно 12, однако КП имеет другую форму, называемую гексагональным кубоктаэдром. Аналогичную структуру имеют минералы осмирид и иридосмин – сплавы Os и Ir.
10) Структура никелина NiAs. В структуре никелина ионы мышьяка образуют ПГУ, во всех октаэдрических пустотах которых расположены ионы Ni. Таким образом, КЧNi=6 и КП у него октаэдр. Ионы As окружены 6 ионами Ni (КЧAs=6), располагающимися в вершинах тригональных призм. Соседние октаэдры никеля имеют общую грань, таким образом, расстояние между атомами металла минимальное возможное. В результате такого расположения атомов никеля между ними возникает слабая металлическая связь. Такие соединения называют кластерными. Структуру типа никелина имеет пирротин Fe1-xS.
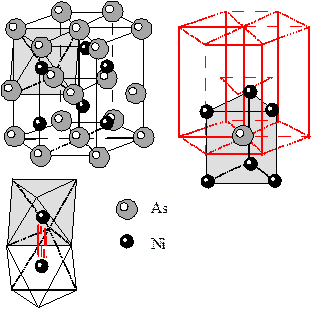
|
|
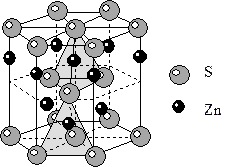
11) Структура вюртцита ZnS. Строится на базе ПГУ атомов серы. Цинк занимает половину тетраэдрических пустот. КЧZn=4, полиэдр – тетраэдр. КЧS=4, полиэдр – тетраэдр.
Способы изображения структур минералов
Существует два основных способа изображения структур минералов. Первый – шариковая модель, когда каждая частица изображается шариком условного цвета, при этом все шарики как правило имеют одинаковый размер. Второй способ был предложен Беловым и Полингом. Он заключается в изображении структуры в виде комбинаций анионных полиэдров.
¯ Анионный полиэдр – координационный многогранник, в вершинах которого располагаются центры тяжести анионов.
В изображении структур по методу Белова–Полинга изображаются только анионы, катионы не изображаются. Например группа [SiO4]2- изображается в виде тетраэдра.
Дата добавления: 2021-02-19; просмотров: 639;











