Синдром системного воспалительного ответа
В последнее время выяснено, что бактериемия не играет роль основного пускового механизма в патогенезе сепсиса. Циркуляция в крови живых бактерий не определяет риск развития, тяжесть проявления и исход септического процесса. Показано, что при тяжелом исходном состоянии летальность выше среди пациентов с отрицательной гемокультурой, чем в группе больных с доказанной бактериемией.
Активированным макрофагам отводится центральная роль в генезе полиорганной недостаточности при сепсисе, отодвигая на второй план бактерии и даже эндотоксин. Фагоцитирующие клетки встречаются практически повсеместно: полиморфноядерные лейкоциты и моноциты в крови; макрофаги в кишечнике, легких, селезенке, коже; остеокласты в костях; купферовские клетки в печени; клетки микроглии в нервной ткани. Фагоциты играют основную роль в процессах воспаления и при повреждении защитных барьеров, осуществляя роль посредника между микрофлорой и макроорганизмом.
В результате постоянного попадания бактерий в подслизистое пространство пищеварительного тракта, верхних дыхательных путей, в крови человека накапливаются конечные продукты фагоцитоза, компоненты клеточных стенок микроорганизмов и продукты микробного метаболизма — низкомолекулярные соединения микробного происхождения (SMOM — small molecules originating from microbes). У здоровых людей содержание SMOM варьирует в определенных пределах, но различия в их качественном и количественном составе в крови несущественны. В крови здоровых доноров постоянно присутствуют около 50 различных SMOM в концентрациях от 0,1 до 1000 нг/мл. Эти молекулы (оксикислоты, ненасыщенные, циклопропановые жирные кислоты, фенолы, индол) никогда не синтезируются клетками человека и по происхождению принадлежат его эндогенной микрофлоре.
SMOM являются сигнальными молекулами для микроорганизмов, активирующими или ингибирующими их размножение. Фагоциты, воспринимая сигналы от SMOM, реагируют изменениями структуры и функциональной активности мембран. Напр., жирно-кислотные компоненты бактериальных клеток индуцируют фагоцитарные реакции, а фенилкарбоновые соединения, наоборот, переводят фагоциты в гипометаболическое состояние. Фенилкарбоновые соединения близки по химическому строению противовоспалительным нестероидным препаратам (ацетилсалициловой кислоте или ибупрофену), что позволяет предположить наличие у них антипростагландинового действия. Постоянное наличие в крови хозяина и тех, и других молекул привело к формированию гомеостаза SMOM:в крови здоровых людей содержание SMOM сбалансировано тем, что эффект активации фагоцитов микробными молекулами уравновешивается влиянием молекул, ингибирующих фагоциты.Достигается это равновесие в результате адекватного функционирования иммунной системы при сохранных биоценозах.
Компоненты бактериальных клеток играют роль в индукции синдрома системного воспалительного ответа. Так, липополисахариды Грам- бактерий индуцируют продукцию цитокинов (ФНО и интерлейкинов) в качестве пусковых факторов. В воспалительном каскаде участвуют десятки медиаторов: эйкозаноиды (простагландины, лейкотриены, тромбоксаны); интерлейкины; ФНО; система комплемента; адгезирующие молекулы; протеолитические энзимы; фактор, повреждающий эндотелий; фактор, активирующий тромбоциты. Все эти медиаторы синтезируются клетками организма хозяина: эйкозаноиды — из арахидоновой кислоты фагоцитов, цитокины — активированными фагоцитами и лимфоцитами.
Несмотря на постоянную «боевую готовность», запуск воспалительного каскада не всегда целесообразен. Если попадание в стерильные среды хозяина бактерий и их фрагментов носит случайный и «неопасный» характер, воспаление не реализуется. Поступление тех же бактерий в кровоток в большой дозе сопровождается бурной воспалительной реакцией, вплоть до шока. В организме хозяина существует система регуляции воспалительного ответа на уровне активации или торможения фагоцитов, которая зависит от гомеостаза SMOM. Развитие воспаления свидетельствует о несоответствии индуцирующих и ингибирующих эффектов (рис. 83).
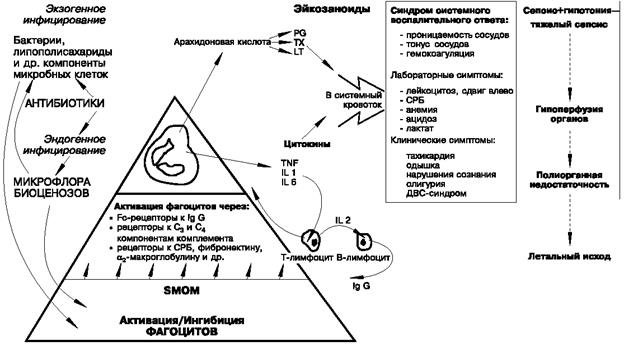
Рис. 83.Концепция о роли малых молекул микробного происхождения (SMOM)
в ответ на инфекцию
Бактерии, их ЛПС и другие компоненты взаимодействуют с фагоцитами, запуская сложный каскад воспалительных реакций. Ключевая роль фагоцитов реализуется при их активации.
Активированный фагоцит — вершина айсберга, в основании которого скрыты процессы регуляции с участием малых молекул микробного происхождения (SMOM). Качественный и количественный состав SMOM формируется за счет микрофлоры биоценозов и гнойно-воспалительных очагов.
Взаимодействие SMOM с фагоцитами определяет нормальную активацию, гипервоспалительную реакцию или гипометаболическое состояние фагоцитов и влияет на иммунологические и клинико-лабораторные проявления сепсиса
Нарушение гомеостаза SMOM может быть связано:
– с нарушением микрофлоры биоценозов, например, при длительном или необоснованном применении антибиотиков широкого спектра действия (карбапенемы, цефалоспорины III и IV поколений). Серьезные микроэкологические поломки приводят к дефициту ингибиторов, что проявляется гиперактивацией фагоцитов и невозможностью прервать запущенный каскад воспалительных реакций;
– с транслокацией микроорганизмов и эндотоксемией при тяжелых травмах, ожогах, операциях;
– с острым массивным инфицированием стерильных тканей, напр., у больных с разлитым перитонитом.
В литературе также обсуждается концепция «небактериального сепсиса». Суть ее состоит в том, что бактерии вследствие бактериальной транслокации циркулируют между кишечником и печенью, не достигая свободного кровотока (гемокультура отрицательная), но поддерживают пролонгированную активацию воспалительного каскада.
Клиника «небактериального сепсиса» может быть обусловлена избыточным поступлением в кровоток SMOM–активаторов при недостатке или отсутствии ингибиторов. SMOM–активаторы поступают в кровь из мест размножения бактерий (из естественных биоценозов и/или из очагов инфекции), если они не утилизируются другими бактериями по ряду причин:
– не могут быть утилизированы бактериями;
– поступают в кровь в избыточном количестве в связи с их гиперпродукцией;
– образуются в обычных количествах, но оказываются бактериями не «востребованы», напр., в случае элиминации бактерий при антибиотикотерапии.
Один из механизмов патогенеза инфекций — адаптация бактерий к характерному для фагоцитов окислительному стрессу.
Антиоксидантные системы бактерий, позволяющие им выживать в очаге воспаления:
– супероксиддисмутаза,
– каталаза,
– системы репарации ДНК,
– субстраты, способные поглощать реактивные кисолородные радикалы и конкурировать с фагоцитами за молекулярный кислород.
Дата добавления: 2021-02-19; просмотров: 493;











