Системы секреции факторов патогенности у Грам- бактерий
| Тип системы секреции | Количество белков | Примеры белков | Особенности секреции |
| I | Несколько десятков крупных белков | a–гемолизин E. coli, аденилатциклаза B. pertussis, протеазы Pseudomonas | Белки не изменяются в процессе транспорта через мембрану. Белковый канал не прерывается в периплазматическом пространстве. Секреция протеинов в один этап, для ее осуществления необходимы три белка |
| II | Более 100 небольших белков | Эластаза, фофолипаза С, экзотоксин Pseudomonas | В процессе транспорта белков через мембрану отщепляется терминальный фрагмент. Белковый канал прерывается в периплазматическом пространстве. Секреция протеинов в два этапа: – транспорт через внутреннюю мембрану с участием комплекса Sec–белков, локализованных во внутренней мембране; – транспорт через наружную мембрану без участия дополнительных белков; секретируемый белок формирует пору в наружной мембране благодаря аутокаталитическим процессам |
| III | Несколько десятков крупных белков. Белки, выявленные у таксономически далеких микроорганизмов, характеризуются значительной гомологиейè общность их происхождения и горизонтальное распространение в виде ОП среди различных видов Грам- бактерий | Белки Shigella, Y. pestis, Klebsiella | Белки не изменяются в процессе транспорта через мембрану. Белковый канал не прерывается в периплазматическом пространстве. Протеины секретируются не в окружающую среду, а транслоцируются непосредственно в ЦП клеток хозяина. Экспрессия белков системы регулируется в зависимости от условий окружающей среды (контакта с эукариотическими клетками) |
| IV | ? | Цитотоксин Helicobacter, Bordetella, белковые токсины Shigella и Escherichia. | Секреция протеинов в два этапа, подобно системе секреции II типа, однако для транспорта через наружную мембрану необходимы дополнительные белки |
Для описания систем секреции обычно используют термин «молекулярный шприц». При электронно-микроскопическом исследовании взаимодействия бактерий с клетками макроорганизма у бактериальных клеток обнаруживается структура, напоминающая шприц, которая прокалывает мембрану эукариотической клетки. Когда Грам- бактерии контактируют с эукариотическими клетками-мишенями, их сенсорные молекулы взаимодействуют с рецепторами на клетках-мишенях. Результатом взаимодействия является секреторный канал («молекулярный шприц») и образование поры в мембране клетки-мишени (рис. 82).
| В ЦПМ бактериальной клетки фиксирована кольцевая белковая структура, играющая основную роль в распознавании секреторных молекул, в инициации процесса секреции и его энергетическом обеспечении. Непосредственно к белковой структуре присоединен белковый канал, проходящий через КС и ЦПМ бактериальной клетки. | 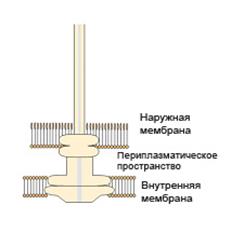
|
| Рис. 82. «Молекулярный шприц» |
В пептидогликановом слое и ЦПМ канал фиксируется кольцевыми белковыми структурами. Над поверхностью микробной клетки выступает филаментозная белковая структура, формирующая пору в мембране эукариотической клетки. Образование поры в мембране эукариотической клетки является ключевым моментом в транслокации факторов патогенности. Через пору и канал цитотоксические молекулы транспортируются в цитозоль клетки-мишени, где они подавляют фагоцитоз, продукцию цитокинов макрофагами, разрушают цитоскелет клетки-мишени и, обычно, индуцируют апоптоз.
Уоблигатнопатогенных бактерий набор факторов патогенности специфичен и универсален для вида. УУП бактерий набор факторов патогенности выраженно вариабелен и мало специфичен, однако факторы активного проникновения во внешнюю среду у них отсутствуют, а патогенное действие УП бактерии оказывают с помощью эндотоксина и ферментов-токсинов.
Факторы патогенности грибов близки к факторам патогенности бактерий, но структура и свойства микотоксинов отличаются от токсинов бактерий.
Среди вирусов отсутствуют непатогенные особи, поэтому термин «патогенность» к ним не применяется, а вирулентность вирусов часто обозначают термином «инфекционность», которая определяется их способностью:
– проникать в восприимчивые клетки;
– нарушать обмен веществ в клетках;
– индуцировать повреждающую иммунную реакцию против инфицированных вирусами клеток.
Генетический контроль факторов патогенности
Факторы патогенности, контролируемые хромосомными генами:
– образование пили общего типа, участвующих в адгезии;
– синтез ферментов-инвазинов: гиалуронидазы и нейраминидазы;
– синтез антифагоцитарных и антикомплементарных веществ: протеина А S. aureus, протеина М S. pyogenes, капсульного полисахарида S. pneumoniae;
– синтез холерогена, экфолиатина S. aureus,энтеротоксина C. perfringens;
– у несущих профаг бактерий обнаружены tox-гены, контролирующие синтез дифтерийного экзотоксина, скарлатинозного эритрогенного токсина, ботулинического нейротоксина.
Факторы патогенности, контролируемые плазмидами:
– факторы адгезии и колонизации,
– образование биоогически активных веществ-пенетринов,
– множественная резистентность к антибиотикам,
– токсичность,
– в некоторых плазмидах tox-гены контролируют синтез протоксинов, которые активируются протеазами (дифтерийный экзотоксин, ботулинический нейротоксин).
Дата добавления: 2021-02-19; просмотров: 496;











