Качественные реакции на аминокислоты, пептиды, белки
Аминокислоты можно обнаружить с помощью цветных реакций: нингидриновой, ксантопротеиновой, Фоля, Милона, биуретовой пробы и др. Эти реакции неспецифичны, т.к. основаны на обнаружении отдельных фрагментов в структуре аминокислот, которые могут встречаться и в других соединениях.
Нингидриновая реакция, цветная реакция, применяемая для качественного и количественного определения аминокислот, иминокислот и аминов. При нагревании в щелочной среде нингидрина (трикетогидринденгидрата, С9НбО4) с веществами, имеющими первичные аминогруппы (—NH2), образуется продукт, который имеет устойчивую интенсивную сине-фиолетовую окраску с максимальным поглощением около 570 нм. Т. к. поглощение при этой длине волны линейно зависит от числа свободных аминогрупп, нингидриновая реакция послужила основой для их количественного определения методами колориметрии или спектрофотометрии. Эта реакция используется также для определения вторичных аминогрупп (>NH) в иминокислотах — пролине и оксипролине; в этом случае образуется продукт ярко-жёлтого цвета. Чувствительность — до 0,01%. Современный автоматический аминокислотный анализ проводят, сочетая ионообменное разделение аминокислот и количественное определение их с помощью нингидриновой реакции. При разделении смесей аминокислот методом бумажной хроматографии позволяет определять каждую аминокислоту в количестве не менее 2—5 мкг.
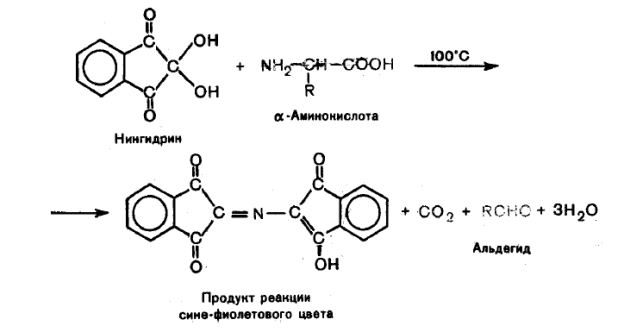
По интенсивности окраски можно судить о количестве аминокислот.
Эта реакция положительна не только со свободными аминокислотами, но и пептидами, белками и др.
Ксантопротеиновая реакция позволяет обнаружить ароматические аминокислоты (фенилаланин, тирозин, гистидин, триптофан), основана на реакции электрофильного замещения в ароматическом ядре (нитрование).
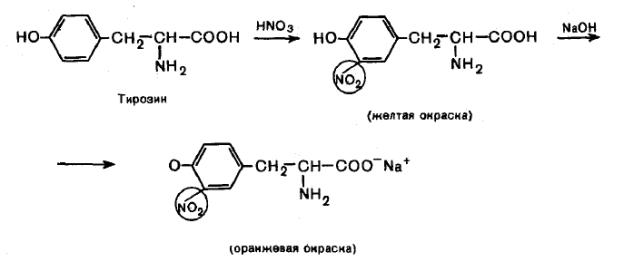
При действии концентрированной азотной кислоты, например, на тирозин образуется продукт, окрашенный в желтый цвет.
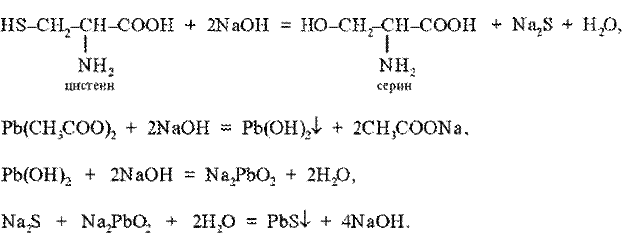
Реакция Фоля. Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
Реакция Циммермана. Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
Реакция на триптофан. Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
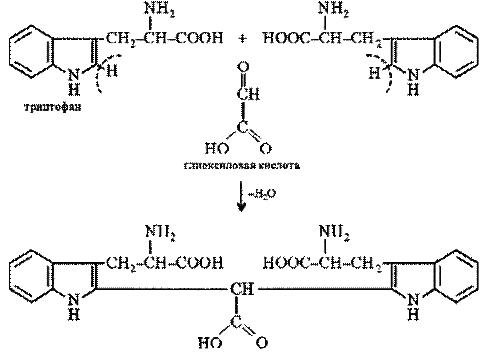
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
Реакция Сакагучи. Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с α-нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
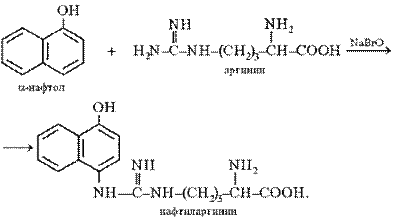
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра α-нафтола:
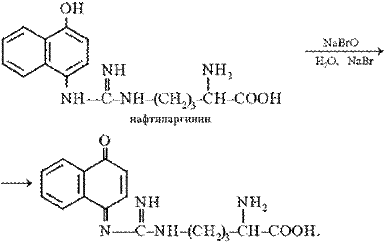
Описание опыта. В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора α-нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
Биуретовая реакция – используется как цветная реакция на белки. В щелочной среде в присутствии солей меди(II) они дают фиолетовое окрашивание. Окраска обусловлена образованием комплексного соединения меди(II), за счет пептидной группы -СО-NH- , которая характерна для белков. Свое название эта реакция получила от производного мочевины - биурета, который образуется при нагревании мочевины с отщеплением аммиака:
Кроме белков и биурета такое же окрашивание дают и другие соединения, содержащие -эту группу: амиды, имиды карбоновых кислот, а также соединения, содержащие в молекуле группы -CS-NH- или =CH-NH-. Также реакцию дают белки, некоторые аминокислоты, пептиды, биурет и средние пептоны.
Цвет комплекса, получаемый при биуретовой реакции с различными пептидами, несколько отличается и зависит от длины пептидной цепи. Пептиды с длиной цепи от четырех аминокислотных остатков и выше образуют красный комплекс, трипептиды – фиолетовый, а дипептиды – синий.
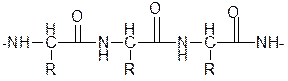
кетонная форма полипептида
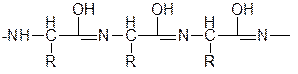
енольная форма полипептида
При взаимодействии полипептида с Cu (OH)2 образуется комплекс, строение которого можно показать так:
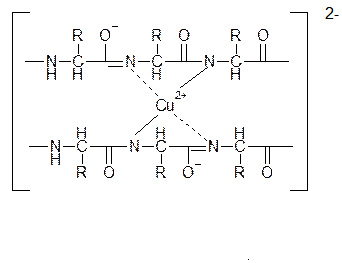
Дата добавления: 2016-11-04; просмотров: 85264;











