Понятие о поверхностной энергии и поверхностном натяжении
Твердые тела и жидкости обладают поверхностями раздела с соседними фазами. Состояние молекул вещества в объеме фазы и в поверхностном слое не одинаково. Основное отличие состоит в том, что поверхностный слой молекул твердого тела или жидкости обладает избытком энергии Гиббса в сравнении с молекулами объемной фазы. Наличие поверхностной энергии Гиббса обусловлено неполной компенсированностью межмолекулярных сил притяжения у молекул поверхностного слоя вследствие их слабого взаимодействия с граничащей фазой.
Рассмотрим действие молекулярных сил на молекулу в глубине и на поверхности жидкости на примере двухфазной системы жидкость-воздух (рис.1)
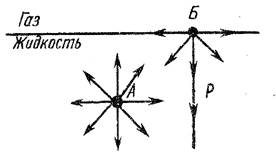 Рис 1
Рис 1
| Выделим молекулу А жидкости в объемной фазе и молекулу Б жидкости в поверхностном слое. Силы сцепления, действующие со стороны окружающих молекул на молекулу А, уравновешивают друг друга, их равнодействующая равна нулю. На молекулу Б, находящуюся на поверхности раздела жидкость-воздух, со стороны граничащих фаз действуют |
силы разного значения, так как суммарные силы притяжения единицы объема жидкости много больше, чем единицы объема воздуха.
Равнодействующая Р сил у молекулы Б направлена вниз перпендикулярно поверхности жидкости. Под влиянием таких некомпенсированных сил находятся все молекулы поверхностного слоя жидкости.
Следовательно, потенциальная энергия молекул на поверхности раздела фаз выше, чем у молекул внутри фазы. Эти отличая в энергетическом состоянии всех молекул поверхностного слоя характеризуются свободной поверхностной энергией Gs.
Свободной поверхностной энергией называется термодинамическая функция, характеризующая энергия межмолекулярного взаимодействия частиц на поверхности раздела фаз с частицами каждой из контактирующих фаз. Свободная поверхностная энергия зависит от количества частиц на поверхности раздела, а потому прямо пропорциональна площади раздела фаз и удельной энергии межфазного взаимодействия:
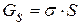 (1)
(1)
где σ – поверхностное натяжение или удельная свободная поверхностная энергия, которая характеризует энергию межфазного взаимодействия единицы площади поверхности раздела фаз; S-площадь поверхности раздела фаз.
Из уравнения (1) следует:
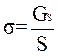 (2)
(2)
Поверхностное натяжение σ является важной характеристикой любой жидкости. Физический смысл поверхностного натяжения может иметь энергетическое и силовое выражение.
Согласно энергетическому выражению, поверхностное натяжение есть поверхностная энергия Гиббса единицы поверхности. В таком случае σ равна работе, затраченной на образование единицы поверхности. Энергетической единицей σ является 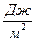 .
.
Силовое определение поверхностного натяжения формулируется следующим образом: σ – это сила, действующая на поверхности по касательной к ней и стремящаяся сократить свободную поверхность тела до наименьших возможных пределов при данном объеме. В этом случае единицей измерения σ является 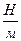 .
.
В гетерогенных системах поверхность раздела, приходящаяся на единицу массы, очень мала. Поэтому величиной поверхностной энергии Гиббса Gs можно пренебречь.
Согласно второму закону термодинамики, энергия Гиббса системы самопроизвольно стремится к минимуму. У индивидуальных жидкостей уменьшение поверхностной энергии Гиббса осуществляется в основном за счет сокращения поверхности (слияние мелких капель в более крупные, шарообразная форма капель жидкости, находящихся во взвешенном состоянии). В растворах уменьшение поверхностной энергии Гиббса может происходить также за счет изменения концентрации компонентов в поверхностном слое.
Поверхностная энергия и поверхностное натяжение зависят от температуры, природы граничащих сред, природы и концентрации растворенных веществ.
Адсорбция, ее основные понятия и виды
Адсорбцией называют концентрирование (сгущение) веществ на поверхности раздела фаз. Вещество, которое адсорбирует другое вещество, называют адсорбентом (рис. 2). Название адсорбируемого вещества зависит от его положения по отношению к адсорбенту. Если вещество находится в объеме и может адсорбироваться (его химический потенциал равен μV, а концентрация с), то его называют адсорбтивом. Это же вещество в адсорбированном состоянии (его химический потенциал уже становится равным μB , а концентрация – сВ) будет называться адсорбатом. Иными словами, для обозначения положения адсорбируемого вещества используют термины адсорбтив (до адсорбции) и адсорбат(после адсорбции).
Рис.2 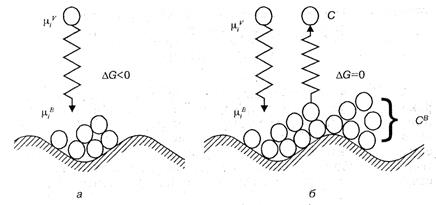
| Молекулы (атомы, ионы, радикалы) адсорбата соприкасаются с поверхностью адсорбента и удерживаются на его поверхности. Поэтому концентрация молекул на поверхности становится больше, чем в объеме соприка сающейся с ней |
жидкости или газа (см. рис.2). Часть молекул с поверхности может перейти обратно в объем. Процесс, обратный адсорбции, называют десорбцией.
В зависимости от агрегатного состояния адсорбента и адсорбтива различают адсорбцию на границе твердого тела и газа (Т-Г), жидкости и газа (Ж-Г) и твердого тела и жидкости (Т-Ж).
Рассмотрим в качестве примера некоторые адсорбционные процессы.
Активированный уголь обладает значительной пористостью и повышенной адсорбционной способностью, хорошо адсорбирует летучие вещества. Входящие в состав молока жиры и белки адсорбируются на границе раздела водная среда-воздух и снижают поверхностное натяжение воды с 73 до 45-60 мДж/м2. Очистку растительных масел от красящих веществ, так называемый процесс отбеливания, осуществляют с помощью бентонитовых глин, выполняющих роль адсорбента. На основе адсорбции проводят очистку и осветление жидкости.
Адсорбция газов на угле происходит на границе Т-Г, жиров и белков – на границе Ж-Г, а красящих веществ на бентоните – по границе двух конденсированных тел Т-Ж. Причем в первом случае адсорбируются молекулы газа или паров на твердой поверхности, а во втором и третьем случае в качестве адсорбата выступает растворенное в жидкости вещество. В ходе всех этих процессов происходит концентрирование веществ на поверхности раздела фаз.
Избыток адсорбата в поверхностном слое по сравнению с его поверхностным количеством в этом слое характеризует избыточную, или так называемую гиббсовскую адсорбцию (Г). Она показывает на сколько увеличилась концентрация адсорбата в результате адсорбции:
Г = А–N (3)
где N-количество адсорбата в адсорбционном слое, когда его концентрация на поверхности соответсвует концентрации в объемной фазе.
Когда концентрация адсорбата на поверхности адсорбента значительно превышает его концентрацию в объеме, т.е. сВ >>с, то величиной N можно пренебречь и считать, что
Г=А (4)
В случае адсорбции на границе раздела жидкость-газ и адсорбции на твердых гладких поверхностях величины Г и А определяют относительно единицы площади границы раздела фаз, т.е. размерность Г и А будет моль/м2.
Для твердого и особенно пористого порошкообразного адсорбента, имеющего значительную границу раздела фаз, адсорбцию выражают по отношению к единице массы адсорбента, т.е. в этом случае величины Г и А имеют размерность моль/кг.
Таким образом, величина адсорбции для i-го компонента
 (5)
(5)
где ni – избыточное число молей адсорбата i-го компонента на поверхности по сравнению с его содержанием в объеме; В – площадь поверхности раздела фаз, м2; m – масса пористого порошкообразного адсорбента, кг.
В случае адсорбции одного компонента уравнения упрощаются:
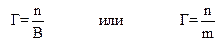 (6)
(6)
Адсорбция на границе раздела жидкость-газ, жидкость-жидкость.
Уравнение адсорбции Гиббса
При растворении в воде поверхностно-активные вещества (ПАВ) накапливаются в поверхностном слое; поверхностно-инактивные вещества (ПИВ), наоборот, концентрируются в объеме раствора. И в том, и в другом случае распределение вещества между поверхностным слоем и внутренним объемом подчиняется принципу минимума энергии Гиббса: на поверхности оказывается то вещество, которое обеспечивает наименьшее поверхностное натяжение, возможное при данных условиях. В первом случае это молекулы ПАВ, во втором – молекулы растворителя (воды). Происходит адсорбция.
Разность концентраций в поверхностном слое и объеме раствора приводит к возникновению сил осмотического давления и процессу диффузии, стремящемуся выравнить концентрации по всему объему.
Когда уменьшение поверхностной энергии, связанное с обеднением или обогащением поверхностного слоя растворенным веществом, будет уравновешено противодействующими силами осмотического давления (или когда химические потенциалы растворенного вещества и растворителя в поверхностном слое будут равны их химическим потенциалам в объеме раствора). В системе наступит подвижное равновесие, которое характеризуется определенной разностью концентраций между поверхностным слоем и объемом раствора.
Избыток или недостаток растворенного вещества в поверхностном слое, отнесенный к единице поверхности. Обозначают через Г, называют гиббсовской адсорбцией и выражают в моль/м2, кг/м2 и т.п.
В тех случаях, когда концентрация адсорбтива в поверхностном слое больше, чем в объеме раствора, Г>0 – адсорбция положительна. Это характерно для растворов ПАВ. При недостатке вещества в поверхностном слое Г<0 – адсорбция отрицательна, что имеет место для растворов ПИВ.
Таким образом, положительной адсорбцией называют адсорбцию, сопровождающуюся накоплением растворенных веществ в поверхностном слое. Отрицательной называют адсорбцию, сопровождающуюся вытеснением растворенного вещества из поверхностного слоя внутрь среды.
Практическое значение имеет только положительная адсорбция, поэтому под термином “адсорбция” имеют в виду именно этот случай.
|
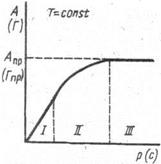
Изотерма адсорбции для жидких поверхностей раздела, т.е. для систем жидкость – газ и жидкость – жидкость, как правило, имеет вид, приведенный на рисунке 3.
Рис 3 Изотерма адсорбции
Наибольшее и постоянное значение адсорбции Г или А, при котором достигается насыщение адсорбционного слоя и адсорбция уже не зависит от концентрации, называют предельной адсорбцией ГПР (АПР).
Пределом положительной адсорбции служит полное насыщение поверхностного слоя молекулами растворенного вещества. Процесс насыщения моно слоя тормозится тепловым движением, которое увлекает часть молекул адсорбированного вещества из поверхностного слоя внутрь раствора. С понижением температуры тепловое движение ослабевает и поверхностный избыток при той же концентрации с раствора увеличивается.
Предел, к которому стремится отрицательная адсорбция – это полное вытеснение растворенного вещества молекулами растворителя из поверхностного слоя.
Простых и доступных способов прямого определения избытка растворенного вещества в адсорбционном слое на подвижных границах раздела фаз пока не существует. Однако на поверхностях раздела жидкость – газ и жидкость – жидкость может быть точно измерено поверхностное натяжение, поэтому для определения адсорбции особенно важным является уравнение изотермы адсорбции Гиббса:
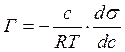 (7)
(7)
где с – концентрация при равновесии адсорбционного слоя и газообразного или растворенного вещества в среде, из которой происходит адсорбция;
dσ – бесконечно малое изменение поверхностного натяжения; R – универсальная газовая постоянная; Т – температура; dс – бесконечно малое изменение концентрации раствора; Г- поверхностный избыток адсорбируемого вещества.
Уравнение Гиббса позволяет определить величину поверхностного избытка по уменьшению величины σ, вызванному изменением концентрации раствора. Г представляет собой разность между концентрациями адсорбтива в поверхностном слое и в объеме раствора. Конечный результат вычисления Г не зависит от способа выражения концентрации с. Знак адсорбции определяется знаком производной 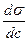 .
.
Если адсорбция положительна, то согласно уравнению (7) 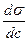 <0, Г>0. При отрицательной адсорбции
<0, Г>0. При отрицательной адсорбции 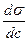 >0, Г<0. Зависимость знака адсорбции от знака
>0, Г<0. Зависимость знака адсорбции от знака 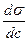 называют правилом Гиббса.
называют правилом Гиббса.
Уравнение изотермы адсорбции Гиббса с точки зрения термодинамики универсально и применимо к границам раздела любых фаз. Однако область практического использования уравнения для определения величины адсорбции ограничена системами, у которых доступно экспериментальное измерение поверхностного натяжения, т.е. системами жидкость-газ и жидкость-жидкость. Рассчитанные по этому уравнению значения Г наиболее близко совпадают со значениями, найденными другими методами, в области разбавленных растворов.
Дата добавления: 2016-11-04; просмотров: 6873;











