Примеры анализа диаграмм состояния
Пример: Охарактеризуйте диаграмму плавкости системы Bi – Cd, приведенной на рисунке 2.32.
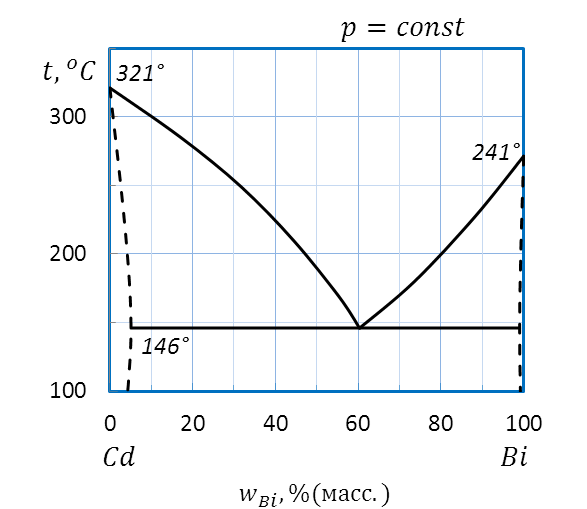
Рисунок 2.32 – Диаграмма состояния Bi – Cd
Решение:
Диаграмма плавкости системы Bi – Cd относится к диаграммам состояния с неограниченной растворимостью в жидком и ограниченной растворимостью компонентов в твердом агрегатных состояниях.
Пример: Дайте описание состояния системы Bi – Cd (рисунок 2.32) в различных условиях, расшифровав значение всех полей, линий и характерных точек диаграммы.
Решение:
По диаграмме плавкости Bi – Cd (рисунок 2.32) определяем температуры плавления чистых веществ: 321˚С для Cd и 241˚С для Bi, соответственно.
Точка E на диаграмме (рисунок 2.33) соответствует эвтектическому составу расплава. Прямая, проходящая через эту точку, называется линией эвтектики.
Кривая Tfus.,Cd – E – Tfus.,Bi – линия ликвидуса, показывает состав жидкой фазы.
Ломаная Tfus.,Cd – E’E’’ –Tfus.,Bi называется линией солидуса, позволяет определить состав твердой фазы.
Выше линии ликвидуса в области I система является гомогенной или однофазной, это область существования жидкой фазы (расплава).
Ниже линии ликвидуса система гетерогенная, т.е. двухфазная. В области II сосуществуют расплав и твердый раствор Bi в Cd, в области III – расплав и твердый раствор Cd в Bi, в гомогенной области IV – твердый раствор Bi в Cd, в гомогенной области V – твердый раствор Cd в Bi. Ниже линии эвтектики в гетерогенной области VI сосуществуют оба твердых раствора совместно Cd в Bi и Bi в Cd
На линии эвтектики E’EE” в равновесии находятся сразу три фазы: два твердых раствора составов E’ и E’’ и расплав состава Е.
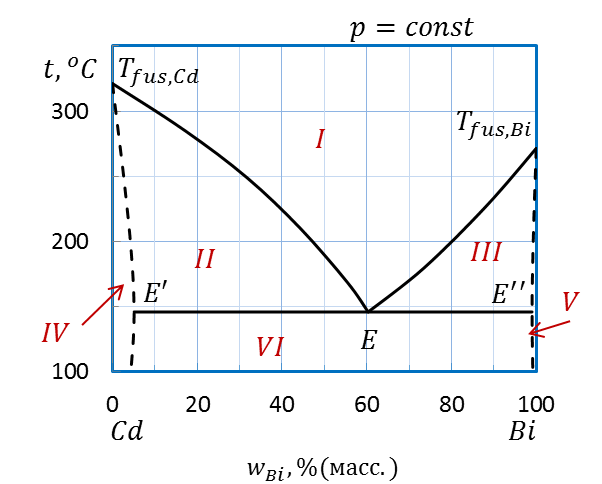
Области: I – расплава, II - расплав и твердый раствор Bi в Cd,
III – расплав и твердый раcтвор Cd в Bi, IV – твердый раствор Bi в Cd,
V – твердый раствор Cd в Bi, VI – твердые растворы Cd в Bi и Bi в Cd
Линии:Tfus.,Cd – E – Tfus.,Bi – линия ликвидуса, Tfus.,Cd – E’E’’ – Tfus.,Bi – линия солидуса,
E’EE” –линия эвтектики
Рисунок 2.33 – Диаграмма состояния Bi – Cd
Пример: Определите температуру начала кристаллизации расплава I (30 % (масс.) Bi, 300˚С) системы Bi – Cd (рис.2.32) и состав первых кристаллов. Как изменяется состав расплава и твердой фазы при охлаждении?
Решение:
Опускаем перпендикуляр от точки I на ось состава (рис. 2.34). Прямая пересекает линию ликвидуса Tfus.,Cd – E – Tfus.,Bi при температуре 250˚С в точке a – температуре начала кристаллизации.
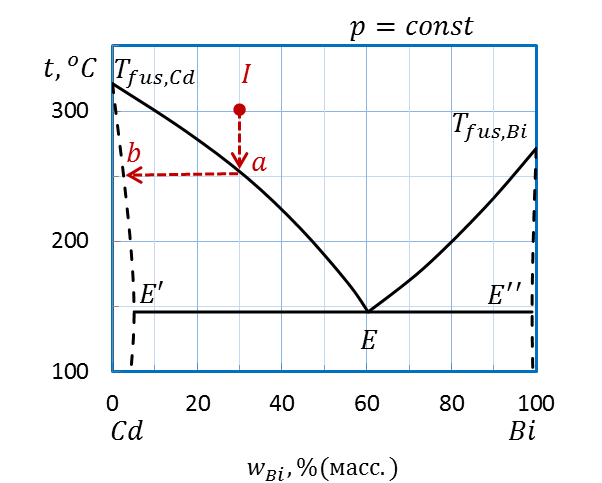
Рисунок 2.34 – Диаграмма состояния Bi – Cd.
Определение температуры начала кристаллизации расплава I
и состава первых кристаллов
Для определения состава первых кристаллов проводим при постоянной температуре внутри гетерогенной области ноду (линию, соединяющую фазы, находящиеся в равновесии) от линии пересечения кривой ликвидуса до линии солидуса Tfus.,Cd – E’E’’ – Tfus.,Bi– точка b. Первые кристаллы – твердый раствор Bi в Cd состава примерно 2 масс.% Bi и 98 масс.% Cd.
При дальнейшем охлаждении (рисунок 2.35) от точки а до точки а’ в системе сосуществуют две фазы: расплав и твердый раствор Bi в Cd. Состав твердого раствора при понижении температуры меняется по кривой Tfus.,Cd– E’ от b (2 % (масс.) Bi) до точки E’ (5 % (масс.) Bi), поскольку при какой бы температуре внутри этой области не проводили бы ноду, один конец ее упирается в линию солидуса Tfus.,Cd– E’, ограничивающей область существования твердого раствора. Другой конец ноды оказывается на линии ликвидуса Tfus.,Cd– E. Состав жидкой фазы при понижении температуры от точки a до точки a’ меняется от точки a (30 % (масс.) Bi) до точки E (60 % (масс.) Bi) по кривой ликвидуса.
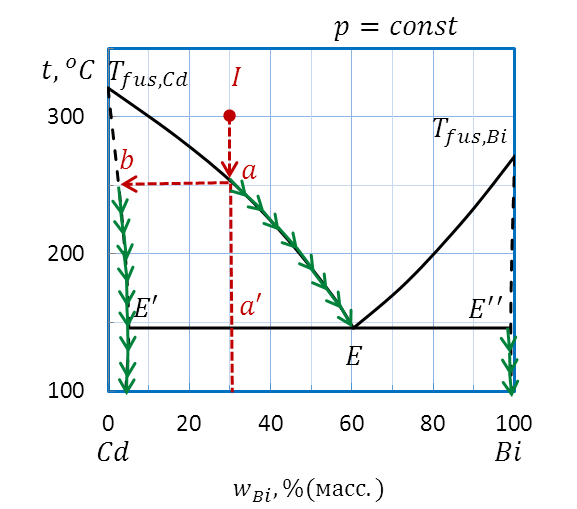
Рисунок 2.35 – Диаграмма состояния Bi – Cd.
Определение состава фаз при охлаждении расплава I
Таким образом, при кристаллизации жидкости исходного состава I меняется как состав твердой, так и жидкой фаз. В обеих фазах при понижении температуры увеличивается содержание Bi, количество твердого раствора увеличивается, количество расплава уменьшается.
По достижении линии эвтектики E’EE” из последних капелек расплава состава Е помимо твердого раствора состава E’ начинает кристаллизоваться еще один твердый раствор состава E” (примерно 98% (масс.) Bi). Температура системы остается постоянной, пока кристаллизация полностью не закончится.
Последующее понижение температуры свидетельствует об охлаждении гетерогенной системы, состоящей из смеси твердых растворов (рисунок 2.35: стрелки на диаграмме от точек E’ и E” вниз).
Пример: Определите температуру начала плавления, количество и состав фаз при этой температуре системы состава II (80 %(масс.) Bi, 100˚С) диаграммы плавкости Bi – Cd, приведенной на рисунке 2.32.
Решение:
Проводим перпендикуляр от точки II вверх (рисунок 2.36). Штриховая прямая пересекает линию эвтектики E’ – E – E’’ при температуре 145˚С – температуре начала плавления.
При температуре эвтектики система состоит из трех фаз: точка E’ показывает состав одной твердой фазы – твердый раствор Bi в Cd (~ 5 % (масс.) Bi) , точка E’’ – состав другой твердой фазы – твердый раствор Cd в Bi (~ 98 % (масс.) Bi), наконец, точка E соответствует составу первых капель жидкой фазы – эвтектического расплава. Состав расплава – 60 % (масс.) Bi и 40 % (масс.) Cd.
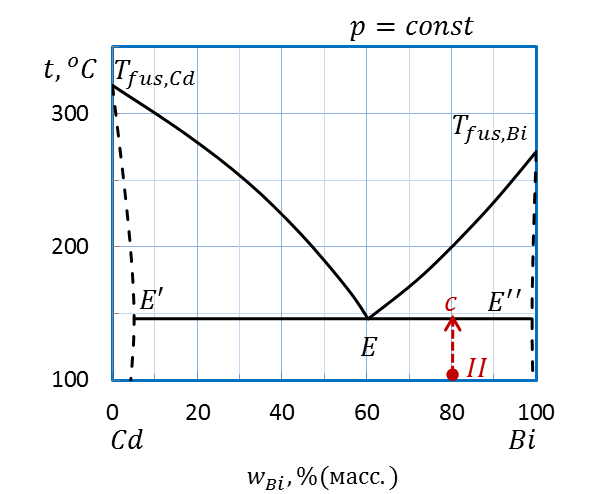
Рисунок 2.36 – Диаграмма состояния Bi – Cd.
Определение температуры начала плавления
Пример: Начертите схематические кривые охлаждения расплавов составов I (30 % (масс.) Bi), II (80 % (масс.) Bi) и III (100 % (масс.) Bi) диаграммы плавкости Bi – Cd (рисунок 2.32), определив число и состав фаз и рассчитав число степеней свободы в характерных точках и на каждом участке кривых охлаждения.
Решение:
Проводим перпендикуляр (или изоплету, т.е. линию постоянного состава, проходящую через несколько температур) от точки I (30 % (масс.) Bi) при температуре 300˚С вниз до оси состава. Штриховая прямая пересекает линию ликвидуса в точке а и линию эвтектики в точке a’, на оси состава ставим точку а”.
Рассчитываем число степеней свободы системы s по правилу фаз Гиббса для диаграммы состояния, построенной при постоянном давлении. Для расчета выделяем интервалы Ia, aa’, точку a’ и интервал a’a’’. Во всех случаях система является двухкомпонентной: Cd и Bi, т.е. k = 2.
Ia:  (f = 1, одна жидкая фаза – двухкомпонентный расплав).
(f = 1, одна жидкая фаза – двухкомпонентный расплав).
aa’: 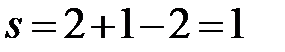 (f = 2, сосуществуют две фазы – расплав и твердый раствор Bi в Cd).
(f = 2, сосуществуют две фазы – расплав и твердый раствор Bi в Cd).
a’:  (f = 3, в равновесии три фазы – расплав, твердый раствор Bi в Cd и твердый раствор Cd в Bi).
(f = 3, в равновесии три фазы – расплав, твердый раствор Bi в Cd и твердый раствор Cd в Bi).
a’a’’: 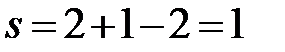 (f = 2, сосуществуют две фазы – твердый раствор Bi в Cd и твердый раствор Cd в Bi).
(f = 2, сосуществуют две фазы – твердый раствор Bi в Cd и твердый раствор Cd в Bi).
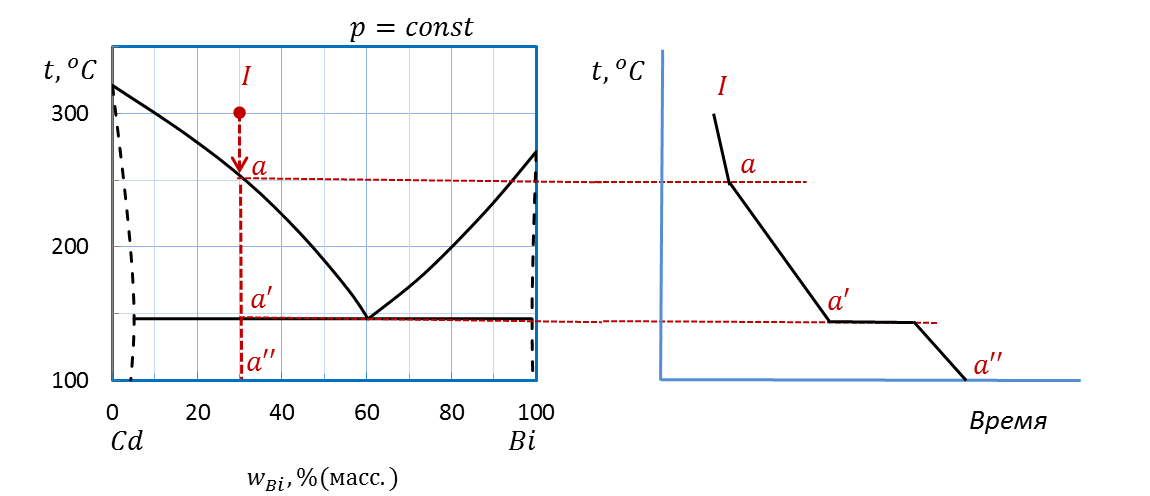
Рисунок 2.37 – Диаграмма состояния Bi – Cd.
Построение кривой охлаждения расплава I
Переносим точки изменения числа фаз a и a’ на соседний график температура - время.
Чертим кривую охлаждения, учитывая, что падение температуры при охлаждении системы более резкое, если система бивариантна (s = 2); более пологое вследствие выделения теплоты при кристаллизации, если система моновариантна(s = 1). Наконец, температура остается постоянной для нонвариантной системы (s = 0).
В случае II (рисунок 2.38) также проводим изоплету (или перпендикуляр) от температуры 300˚С вниз до оси состава. Штриховая прямая пересекает линию ликвидуса в точке b и линию эвтектики в точке b’, на оси состава ставим точку b”.
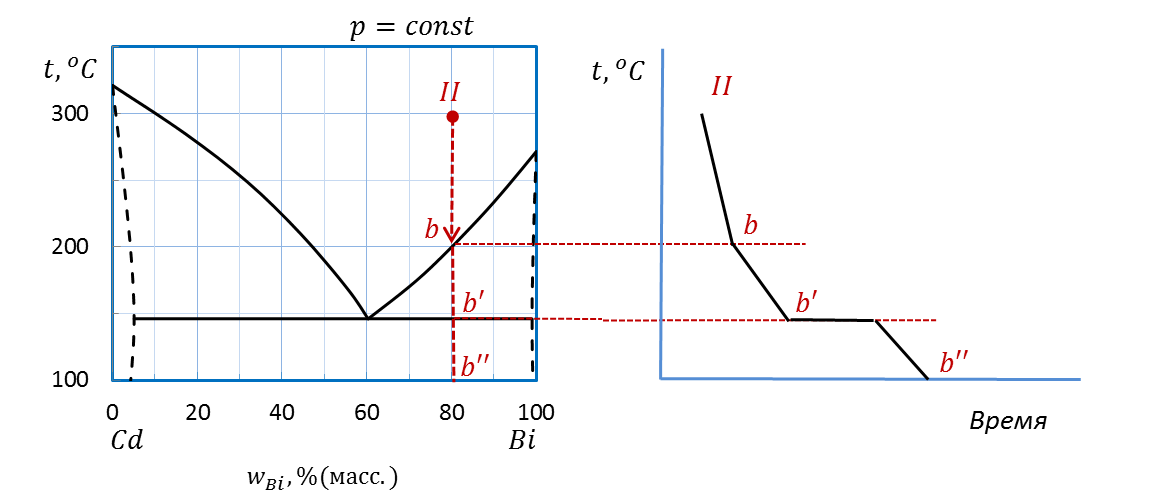
Рисунок 2.38 – Диаграмма состояния Bi – Cd.
Построение кривой охлаждения расплава II
Для расчета выделяем интервалы IIb, bb’, точку b’ и интервал b’b’’. Во всех случаях система так же, как и в первом случае, является двухкомпонентной: Cd и Bi, т.е. k = 2.
IIb: 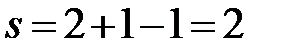 (f = 1, одна жидкая фаза – двухкомпонентный расплав).
(f = 1, одна жидкая фаза – двухкомпонентный расплав).
bb’: 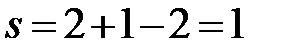 (f = 2, сосуществуют две фазы – расплав и твердый раствор Cd в Bi).
(f = 2, сосуществуют две фазы – расплав и твердый раствор Cd в Bi).
b’: 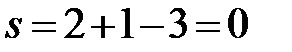 (f = 3, в равновесии три фазы – расплав, твердый раствор Cd в Bi и твердый раствор Bi в Cd).
(f = 3, в равновесии три фазы – расплав, твердый раствор Cd в Bi и твердый раствор Bi в Cd).
b’b’’: 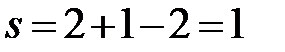 (f = 2, сосуществуют две фазы – твердый раствор Cd в Bi и твердый раствор Bi в Cd).
(f = 2, сосуществуют две фазы – твердый раствор Cd в Bi и твердый раствор Bi в Cd).
Сносим точки изменения числа фаз b и b’ на график температура-время.
Рисуем схематично кривую охлаждения аналогично примеру I.
В случае III (рисунок 2.39) проводим изоплету от температуры 300˚С до оси состава. Штриховая прямая пересекает температуру плавления Bi в точке c, на оси состава ставим точку c’.
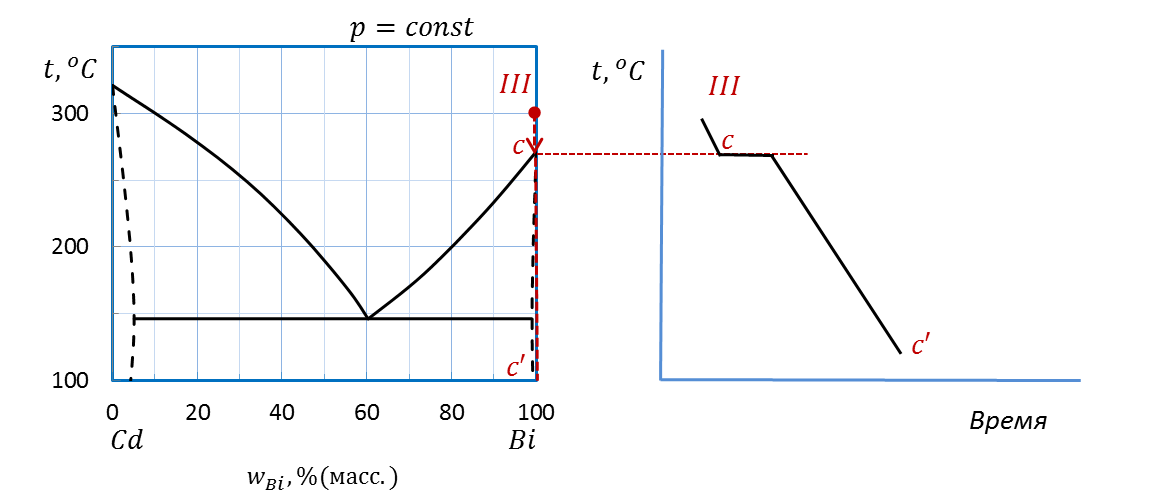
Рисунок 2.39 – Диаграмма состояния Bi – Cd.
Построение кривой охлаждения расплава III
Для расчета выделяем интервалы IIIc, точку c и интервал cc’. Во всех случаях система является однокомпонентной: один компонент Bi, т.е. k = 1.
IIIc: 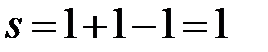 (f = 1, одна жидкая фаза – жидкий Bi).
(f = 1, одна жидкая фаза – жидкий Bi).
c: 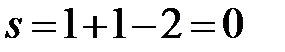 (f = 2, в равновесии две фазы – жидкий и кристаллический Bi).
(f = 2, в равновесии две фазы – жидкий и кристаллический Bi).
cc’: 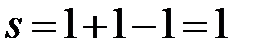 (f = 1, одна твердая фаза – кристаллы Bi).
(f = 1, одна твердая фаза – кристаллы Bi).
Переносим точку изменения числа фаз c на график температура – время.
Чертим кривую охлаждения аналогично случаям I и II.
Пример: Начертите схематическую кривую охлаждения расплава состава a (60 % B) диаграммы плавкости A – B (рисунок 2.26), определив число и состав фаз и рассчитав число степеней свободы в характерных точках и на каждом участке кривой охлаждения.
Решение:
Проводим изоплету (рисунок 2.40) от фигуративной точки d до оси состава. Штриховая прямая пересекает кривую ликвидуса в точке d’, кривую солидуса – в точке d’’, на оси состава ставим точку d’’’.
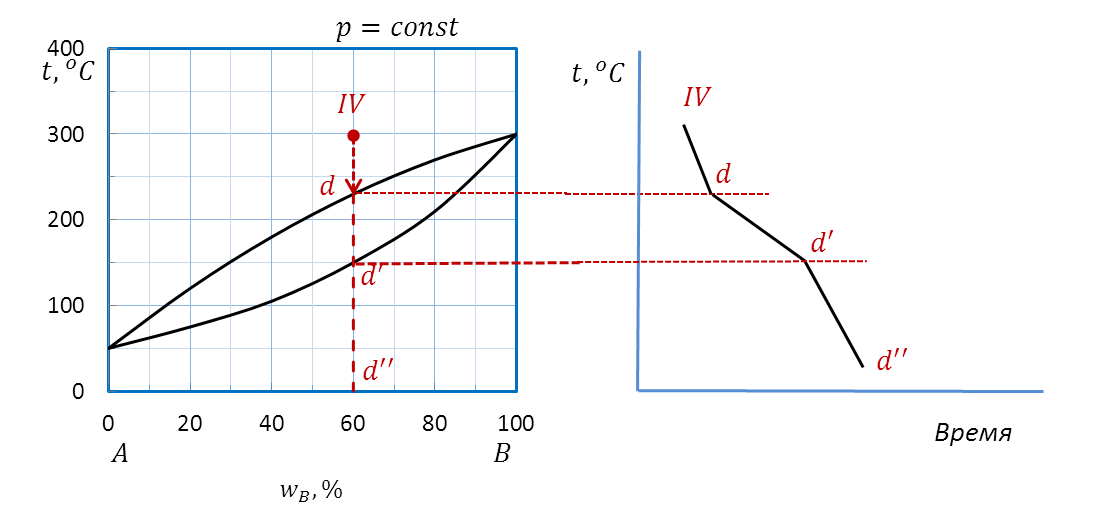
Рисунок 2.40 – Диаграмма состояния A – B.
Построение кривой охлаждения расплава IV.
Для расчета вариантности системы выделяем интервалы dd’, d’d’’ и интервал d’’d’’’. Во всех случаях система является двухкомпонентной, т.е. k = 2.
dd’: 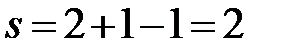 (f = 1, одна жидкая фаза – расплав).
(f = 1, одна жидкая фаза – расплав).
d’d’’: 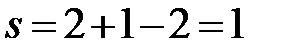 (f = 2, в равновесии две фазы – расплав и твердый раствор A и B).
(f = 2, в равновесии две фазы – расплав и твердый раствор A и B).
d’’d’’’: 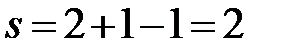 (f = 1, одна твердая фаза – твердый раствор A и B).
(f = 1, одна твердая фаза – твердый раствор A и B).
Переносим точки изменения числа фаз на график температура – время.
Чертим кривую охлаждения. На кривой охлаждения видны точки перегиба, соответствующие температурам начала (d’) и конца кристаллизации (d’’).
Пример: Вычислите массы равновесных фаз при температуре 200оС для 10 кг исходной смеси состава l (20 %(масс.)Bi) диаграммы плавкости Cd – Bi, приведенной на рисунке 2.32.
Решение:
Для вычисления масс фаз, находящихся в равновесии, при температуре 200оС проводим через состав l (20 %(масс.) Bi) ноду внутри гетерогенной области kn. Один конец ноды k показывает состав твердой фазы – примерно 4 % (масс.) Bi и 96 %(масс.) Cd, другой конец ноды n находится на кривой ликвидуса и позволяет определить состав сосуществующей жидкой фазы: 47 % (масс.) Bi и 53 % (масс.) Cd, соответственно.
Составляем правило рычага:
kl ∙ ms = ml ∙ ln.
При подстановке вместо отрезков разности составов, выраженных, например, по %(масс.) Bi, получаем уравнение:
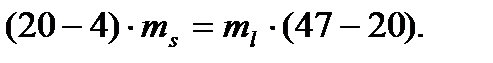 j
j

Рисунок 2.41 – Диаграмма состояния Bi – Cd.
Вычисление массы равновесных фаз системы состава l по правилу рычага
Второе уравнение, необходимое для решения, связывает массы равновесных фаз и массу исходной смеси (10 кг):
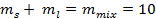 кг
кг
Решаем совместно оба уравнения. Результат:
 кг;
кг;
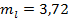 кг.
кг.
Пример: Определите формулу химического соединения, образующегося между компонентами системы Te – Al (рисунок 2.42) в твердом агрегатном состоянии.
Решение:
В системе Te – Al между компонентами в твердом агрегатном состоянии возможно образование химического соединения AlxTey с температурой плавления 895оС.
Для определения х и y в формуле этого соединения пересчитываем состав по первому и второму компонентам, выраженный в %(масс.) (w), в % (ат.) или %(мол.) (x) по формулам:
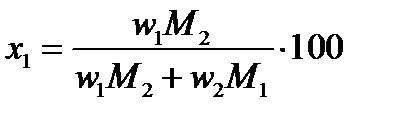 и и 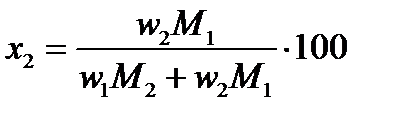
| (2.30) |
Для данной диаграммы wAl = 12%(масс.), wTe = 88%(масс.), MAl = 26,98 г/моль, MTe = 127,60 г/моль.
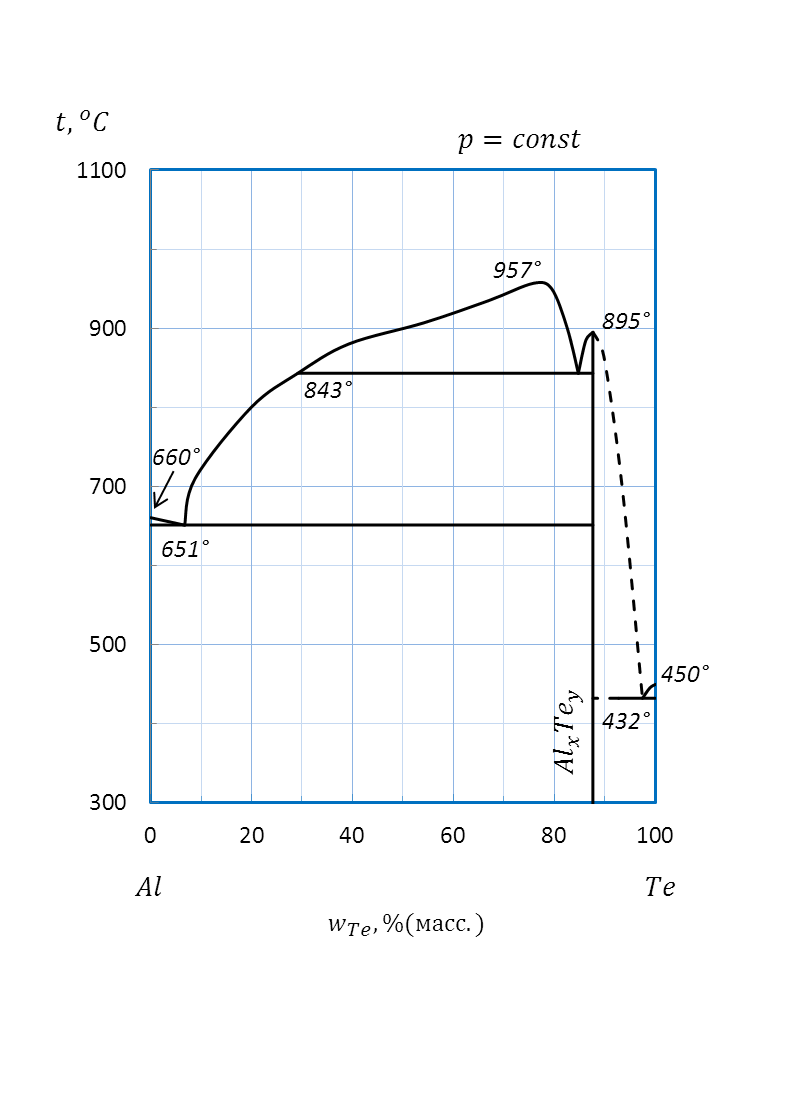
Рисунок 2.42 – Диаграмма состояния Te – Al.
Подстановка значений дает:
 % (мол.) Al,
% (мол.) Al,
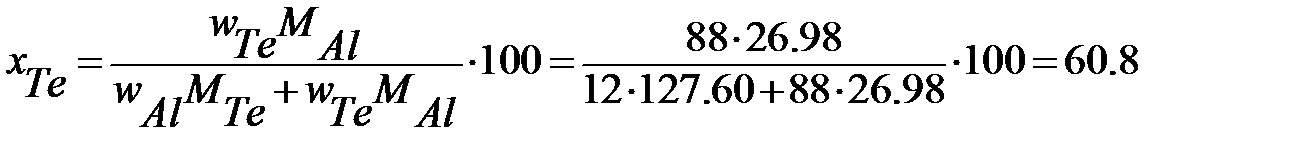 % (мол.) Te.
% (мол.) Te.
Отношение полученных составов, выраженных в % (ат.) или % (мол.), позволяет определить формулу химического соединения AlxTey:
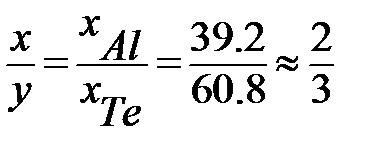 или Al2Te3 .
или Al2Te3 .
2.2.3.9 Многовариантное задание № 7 «Анализ диаграмм плавкости»
1. Охарактеризуйте диаграмму плавкости системы A – B (таблица 2.6): растворимость компонентов в жидких и твердых фазах, типы твердых растворов, наличие устойчивых и неустойчивых химических соединений.
2. Дайте описание состояния системы в различных условиях, расшифровав значение всех полей, линий и характерных точек диаграммы плавкости системы A – B (таблица 2.6).
3. Определите температуру начала кристаллизации расплава состава I и состав первых кристаллов. Как изменяется состав расплава и твердой фазы при охлаждении?
4. Определите температуру начала плавления, количество и состав фаз при этой температуре для системы состава II.
5. Начертите схематические кривые охлаждения расплавов состава I, II и III, определив число и состав фаз и рассчитав число степеней свободы в характерных точках и на каждом участке кривой охлаждения.
6. Вычислите массы равновесных фаз при заданной температуре t,оС и количестве исходной смеси состава III.
7. Для систем, образующих химические соединения, определите формулы этих соединений.
Таблица 2.6 – Варианты заданий
| Вар. | Система A-B | Количество исходной смеси | Подвариант | Составы исходной смеси по A,% | t, оС | ||
| I | II | III | |||||
| Mg – Cu | 500 г | ||||||
| Cr – Sn | 5 кг | ||||||
| Cd – Cu | 800 г | ||||||
| Cd – Hg | 4 кг | ||||||
| -75 | |||||||
| Sn – Ag | 300 г | ||||||
| Ca – Cu | 600 г | ||||||
Продолжение таблицы 2.6
| Вар. | Система A-B | Количество исходной смеси | Подвариант | Составы исходной смеси по A,% | t, оС | ||
| I | II | III | |||||
| Zn – Mg | 700 г | ||||||
| Bi – Co | 2 кг | 99,995 | |||||
| 99,985 | |||||||
| Sb – Ag | 400 г | ||||||
| CuCl – LiCl | 2 моля | ||||||
| AgCl – LiCl | 300 г | ||||||
| Ag2SO4 - Na2SO4 | 400 г | ||||||
| MnSiO3 – CaSiO3 | 800 г | ||||||
Продолжение таблицы 2.6
| Вар. | Система A-B | Количество исходной смеси | Подвариант | Составы исходной смеси по A,% | t, оС | ||
| I | II | III | |||||
| NaCl – LiCl | 0,5 моля | ||||||
| NaNO3 – NaNO2 | 500 г | ||||||
| TlCl – KCl | 800 г | ||||||
| PbCl2 – KCl | 500 г | ||||||
| PbBr2 – PbF2 | 300 г | ||||||
| TlCl – CuCl | 800 г | ||||||
| PbCl2 – PbF2 | 400 г | ||||||
Продолжение таблицы 2.6
| Вар. | Система A-B | Количество исходной смеси | Подвариант | Составы исходной смеси по A,% | t, оС | ||
| I | II | III | |||||
| CuBr – KBr | 800 г | ||||||
| TlCl – AgCl | 0,2 моля | ||||||
| ВаCl2 – BaF2 | 300 г | ||||||
| CaAl2Si2O8 – 2NaAlSiO4 | 6 кг | ||||||
| TlNO2 – NaNO2 | 300 г | ||||||
| NaOH – NaF | 2 кг | ||||||
| CaMgSi2O6 – NaAlSi2O6 | 6 кг | ||||||
Продолжение таблицы 2.6
| Вар. | Система A-B | Количество исходной смеси | Подвариант | Составы исходной смеси по A,% | t, оС | ||
| I | II | III | |||||
| NaNO3 – KNO3 | 4 кг | ||||||
| FeI2 – CrI2 | 700 г | ||||||
| MgAl2O4 – ZrO2 | 4 кг | ||||||
| Sn - Pb | 4 кг | ||||||
| Si – Ag | 700 г | ||||||

Рисунок 2.43 – Диаграмма состояния системы 
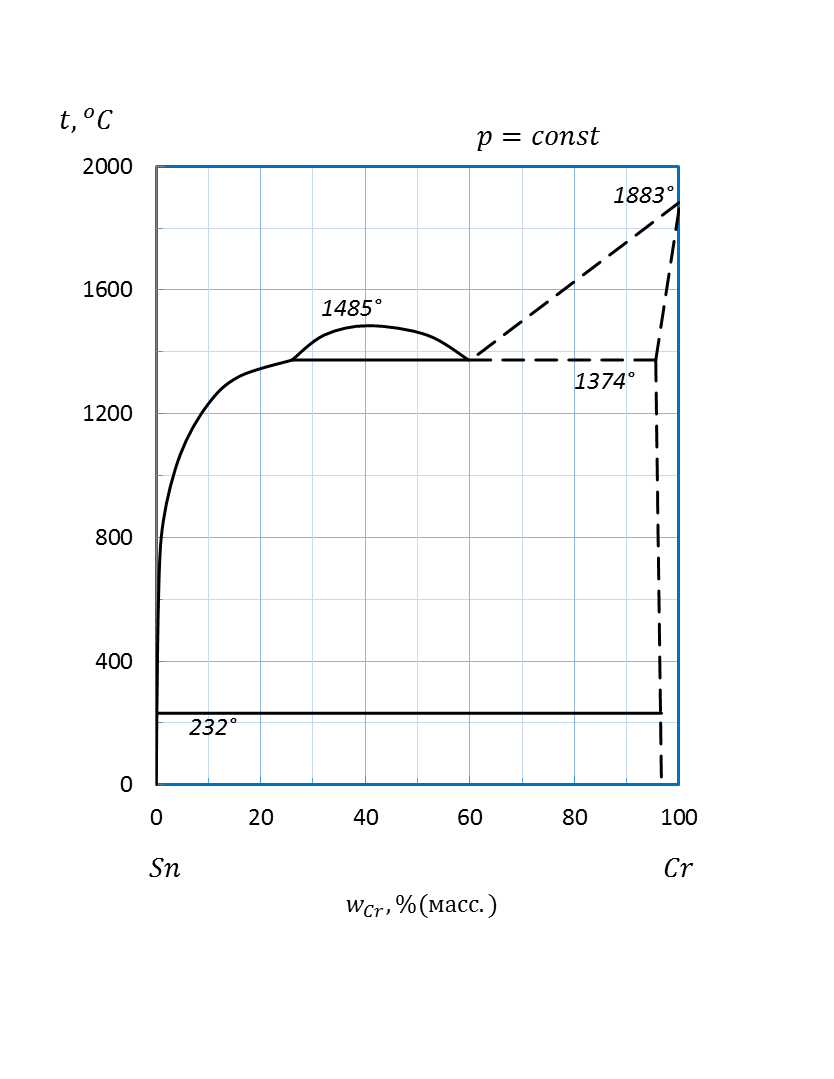
Рисунок 2.44 – Диаграмма состояния системы 
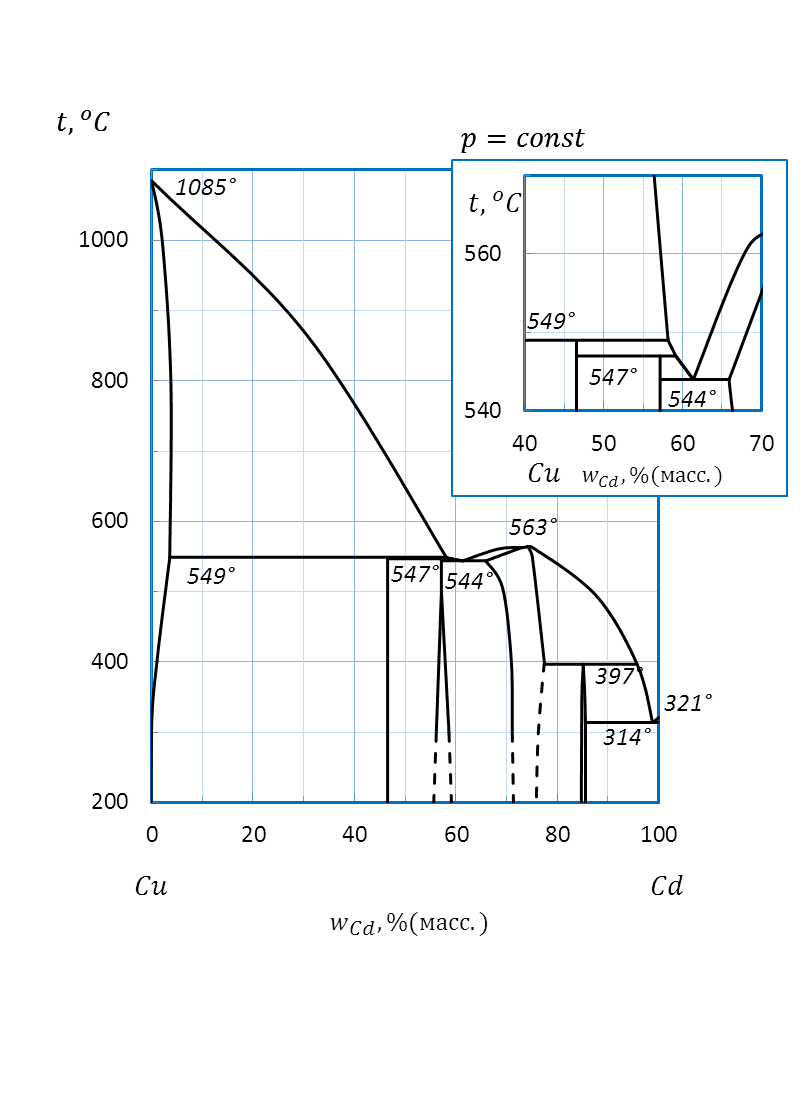
Рисунок 2.45 – Диаграмма состояния системы 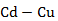
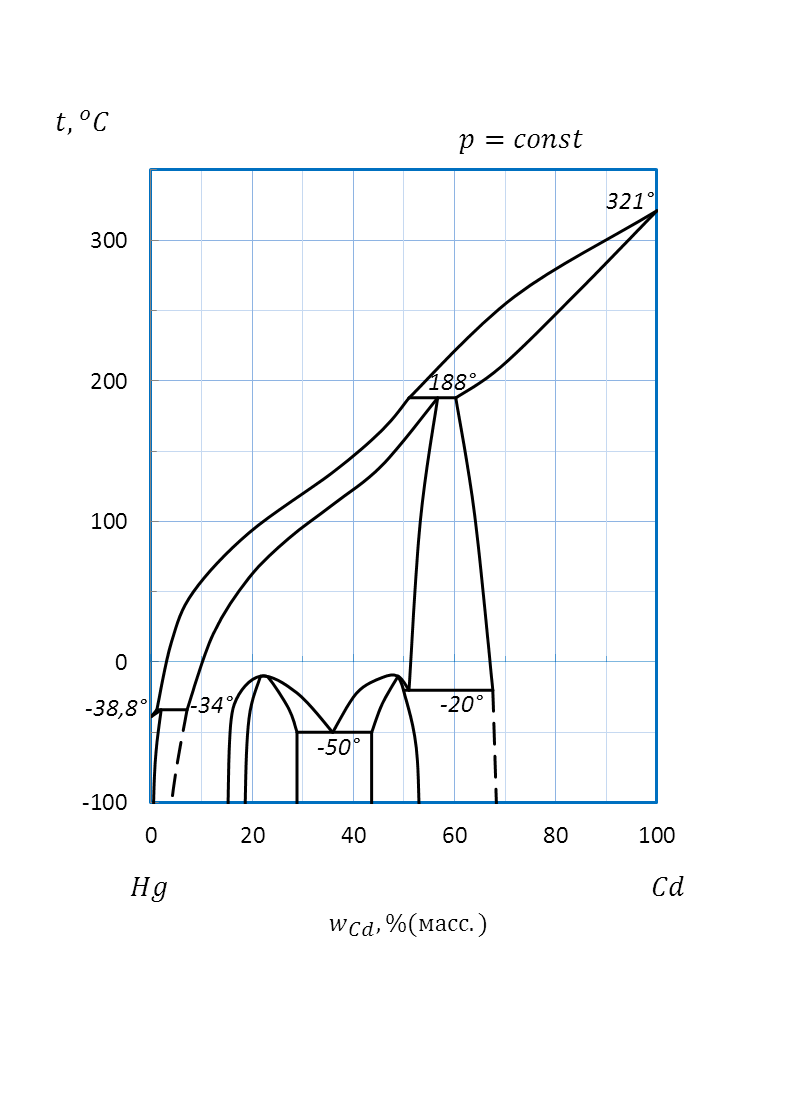
Рисунок 2.46 – Диаграмма состояния системы 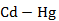

Рисунок 2.47 – Диаграмма состояния системы 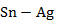
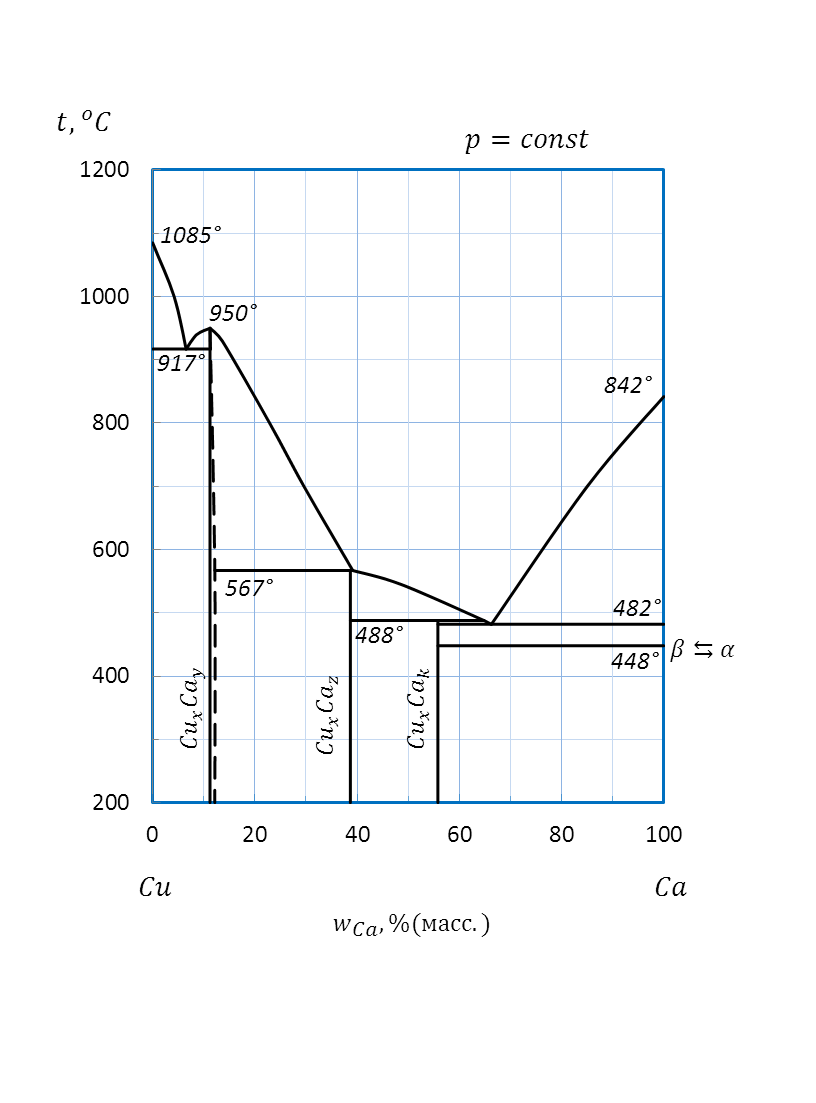
Рисунок 2.48 – Диаграмма состояния системы 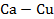
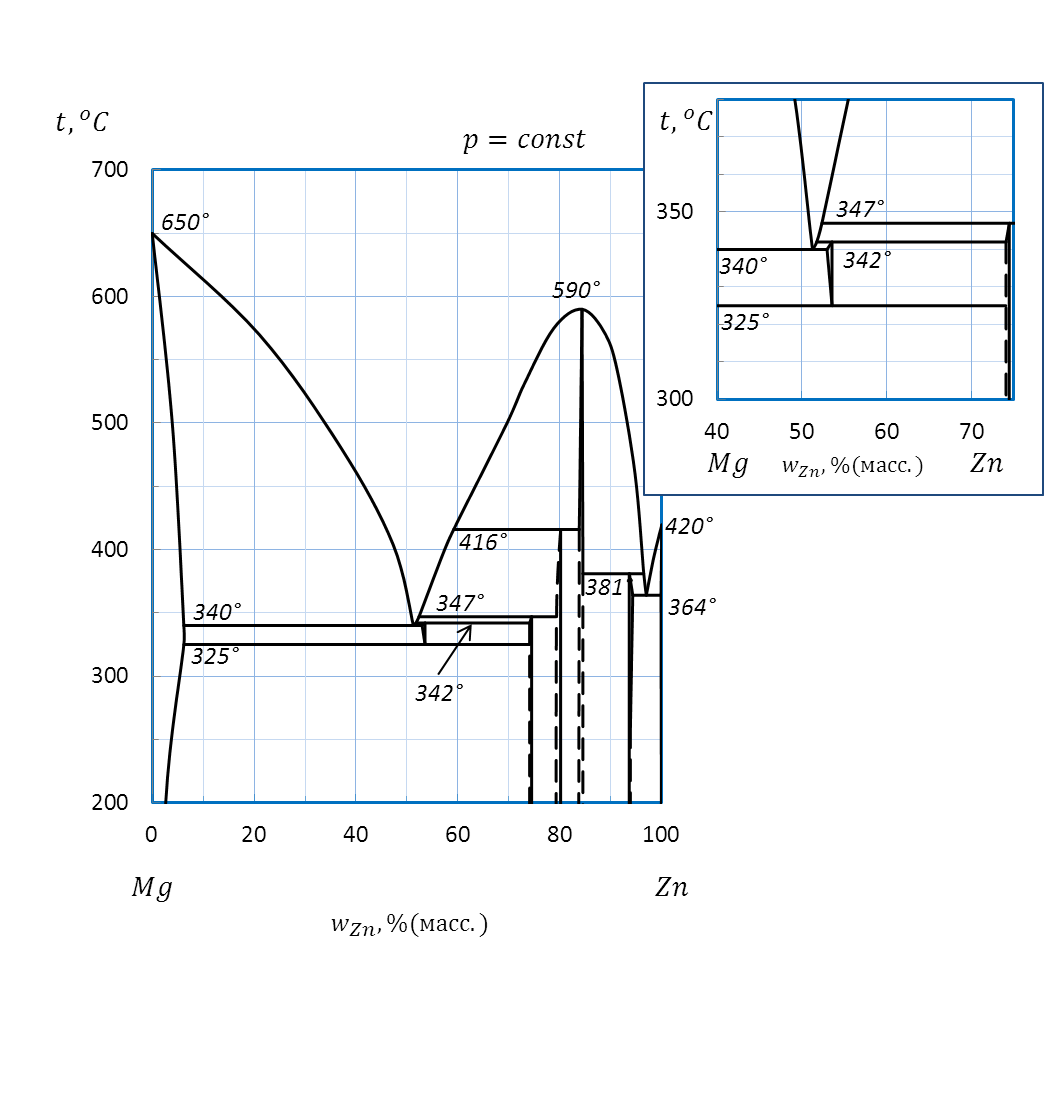
Рисунок 2.49 – Диаграмма состояния системы 
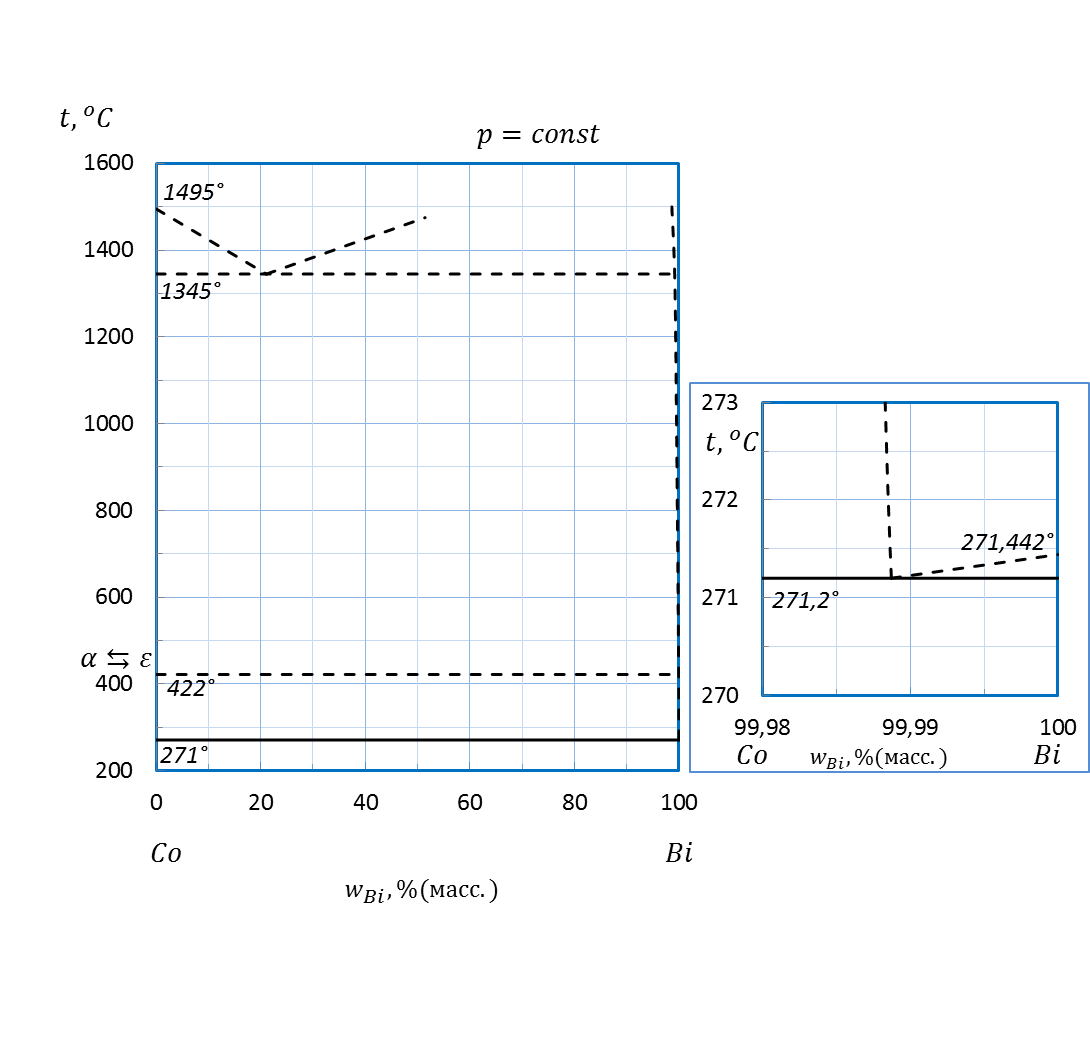
Рисунок 2.50 – Диаграмма состояния системы 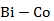
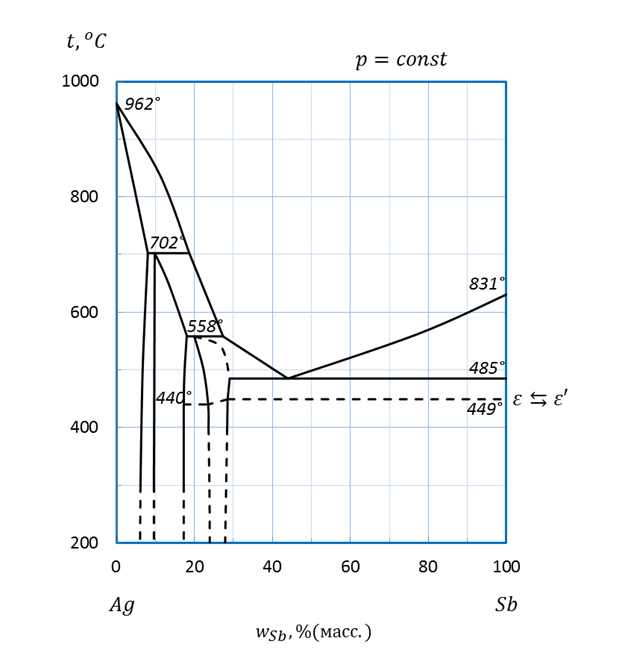
Рисунок 2.51 – Диаграмма состояния системы 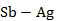
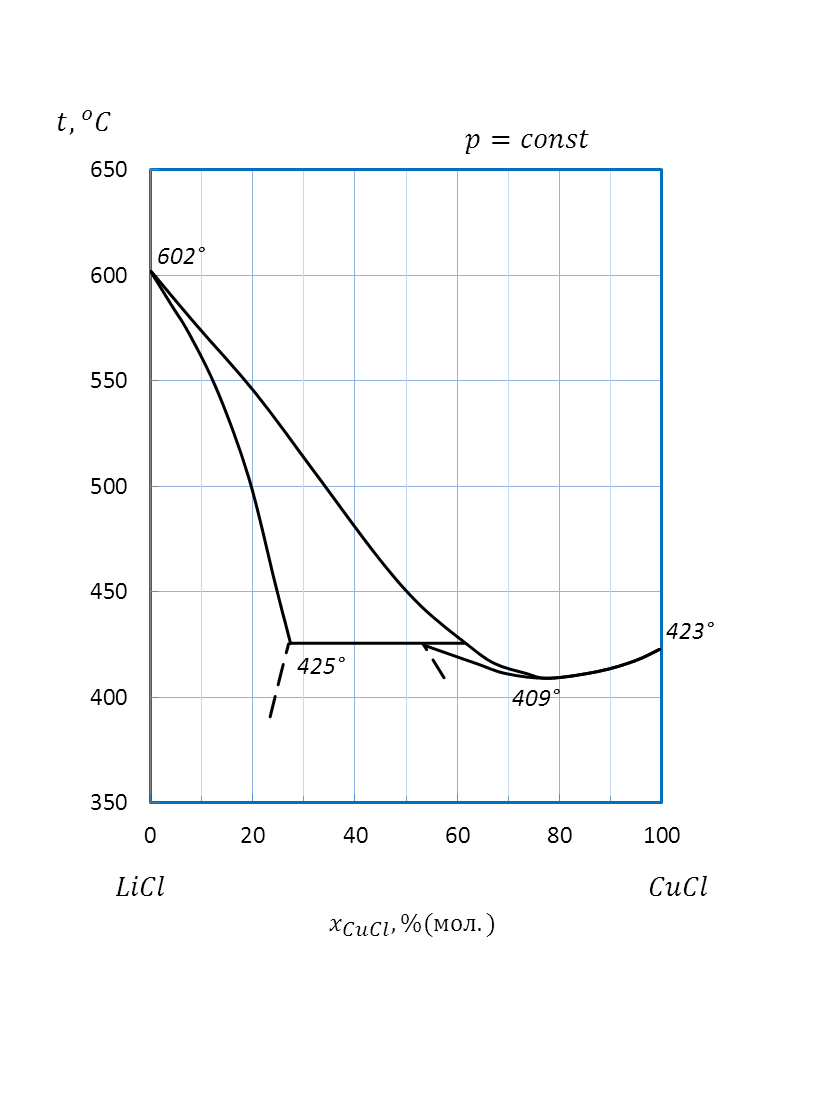
Рисунок 2.52 – Диаграмма состояния системы 

Рисунок 2.53 – Диаграмма состояния системы 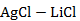
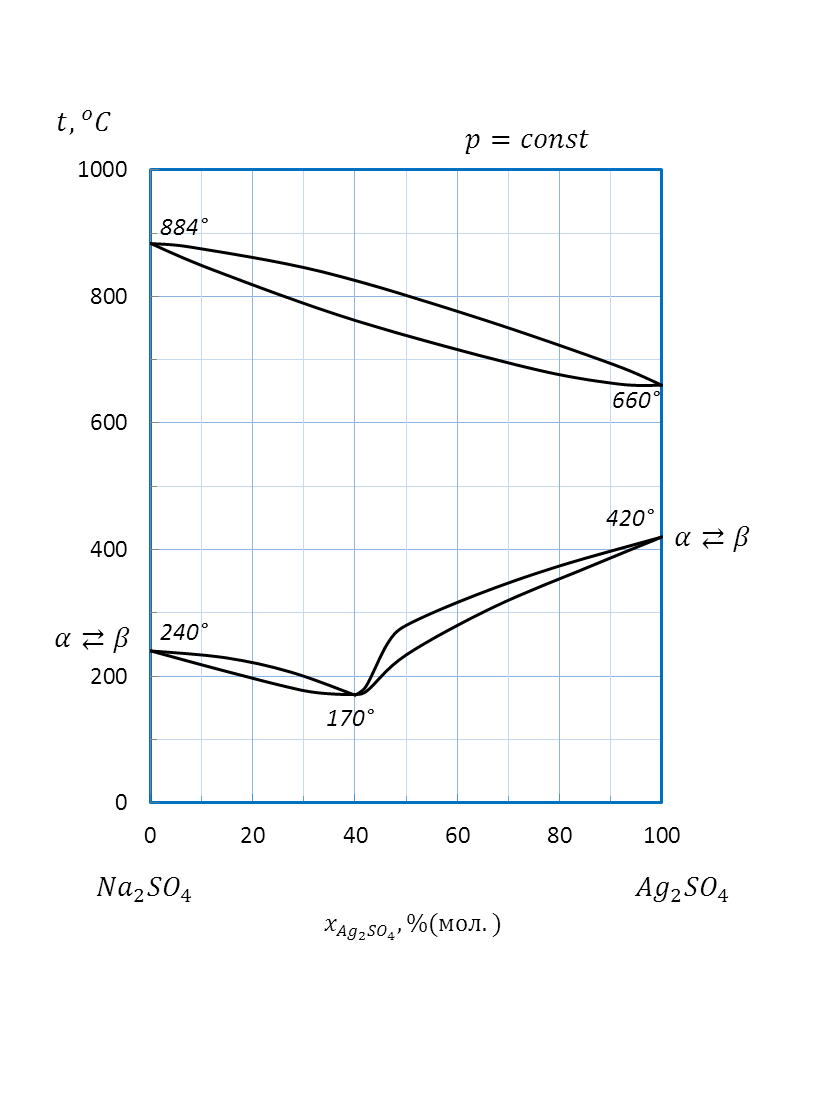
Рисунок 2.54 – Диаграмма состояния системы 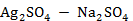
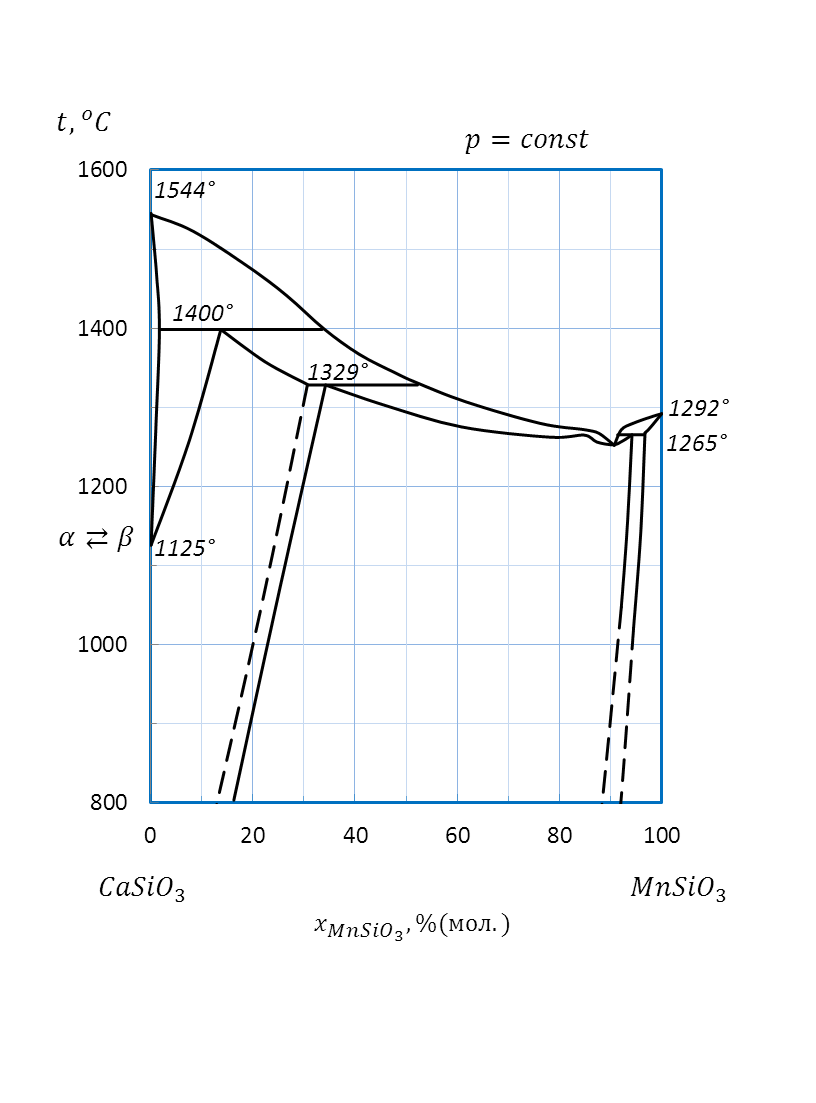
Рисунок 2.55 – Диаграмма состояния системы 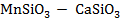
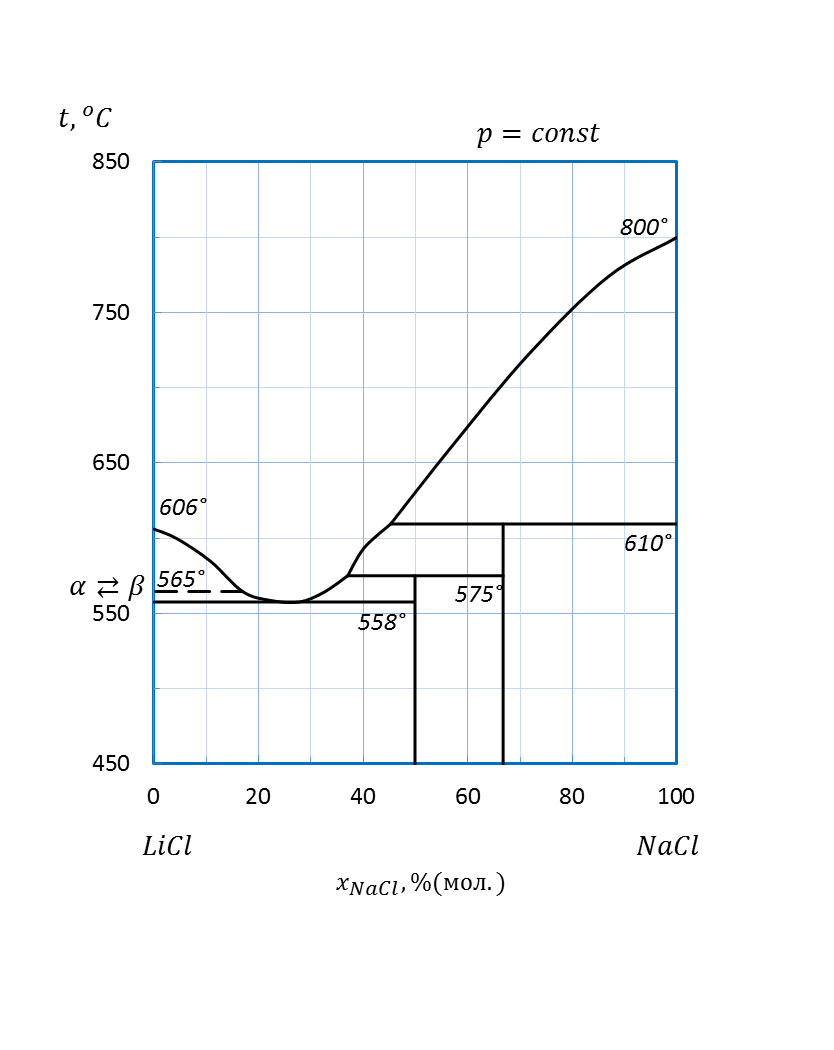
Рисунок 2.56 – Диаграмма состояния системы 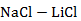
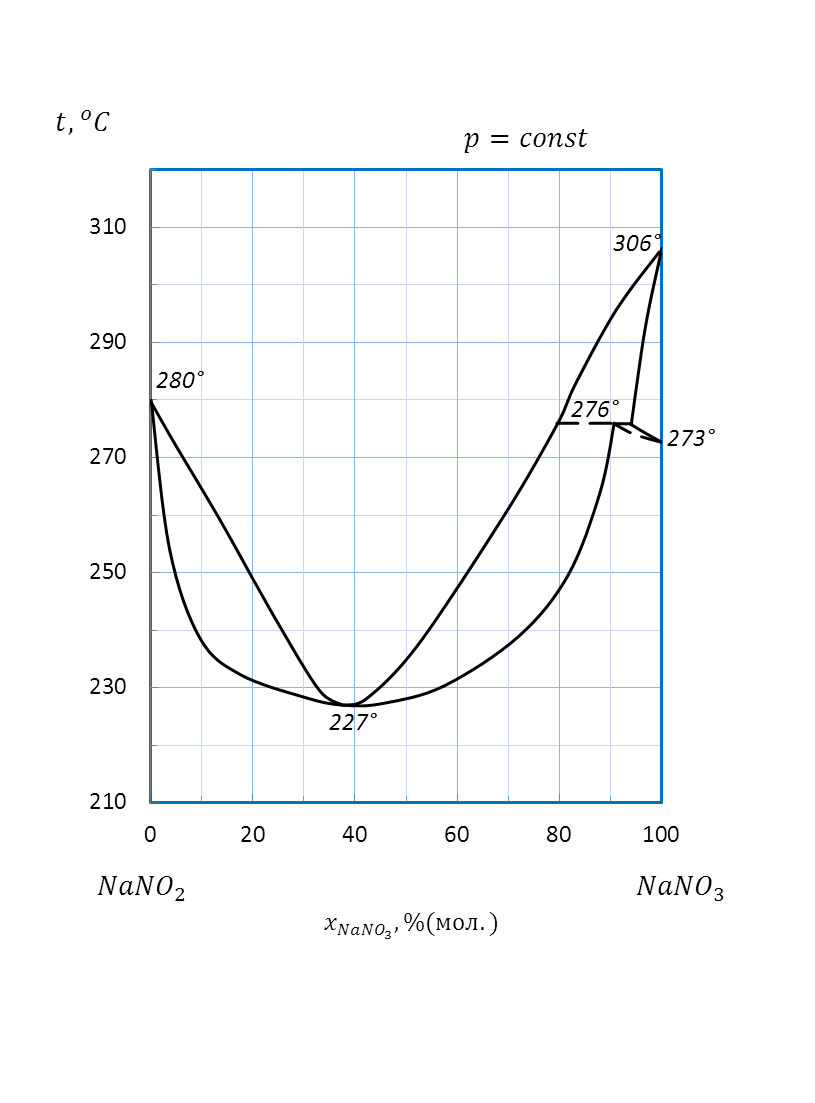
Рисунок 2.57 – Диаграмма состояния системы 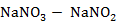
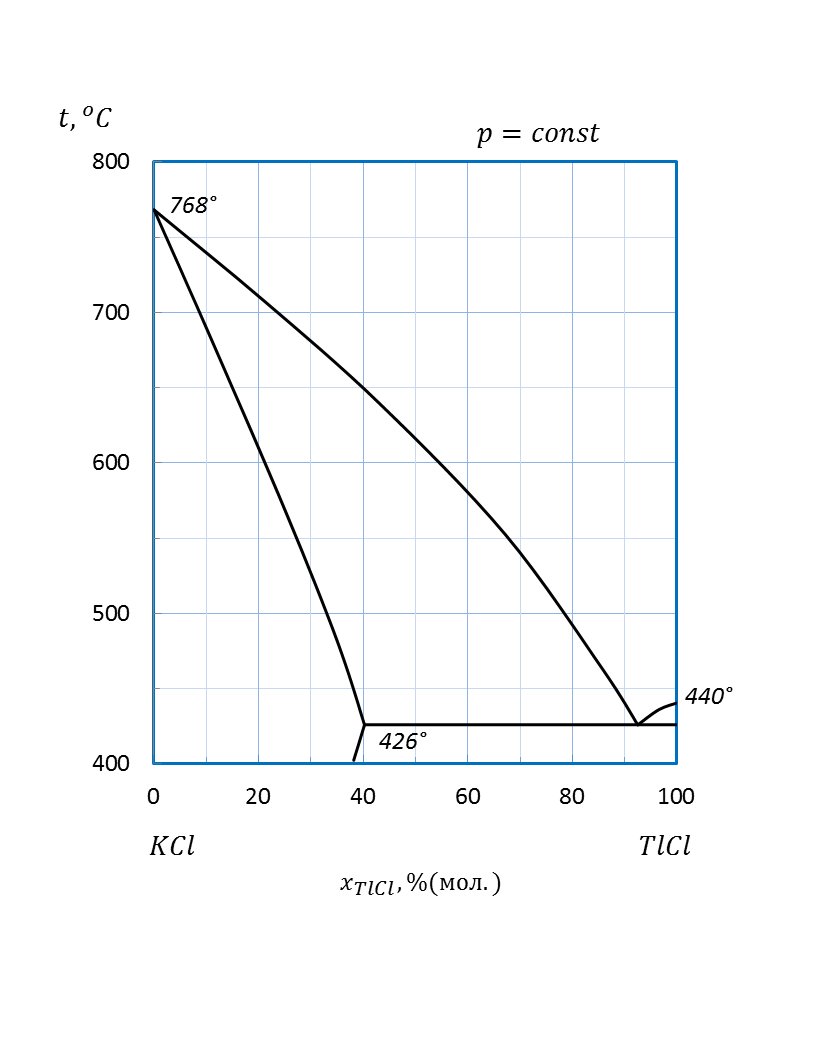
Рисунок 2.58 – Диаграмма состояния системы 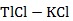

Рисунок 2.59 – Диаграмма состояния системы 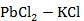

Рисунок 2.60 – Диаграмма состояния системы 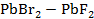
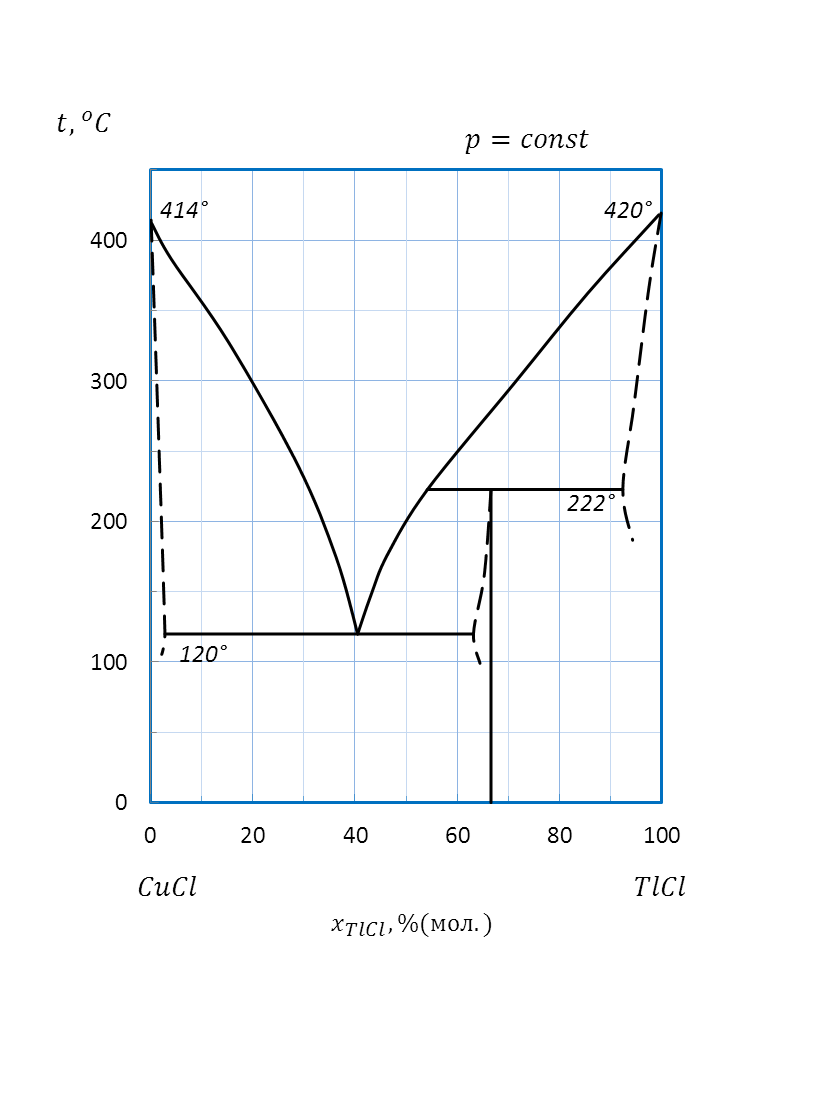
Рисунок 2.61 – Диаграмма состояния системы 
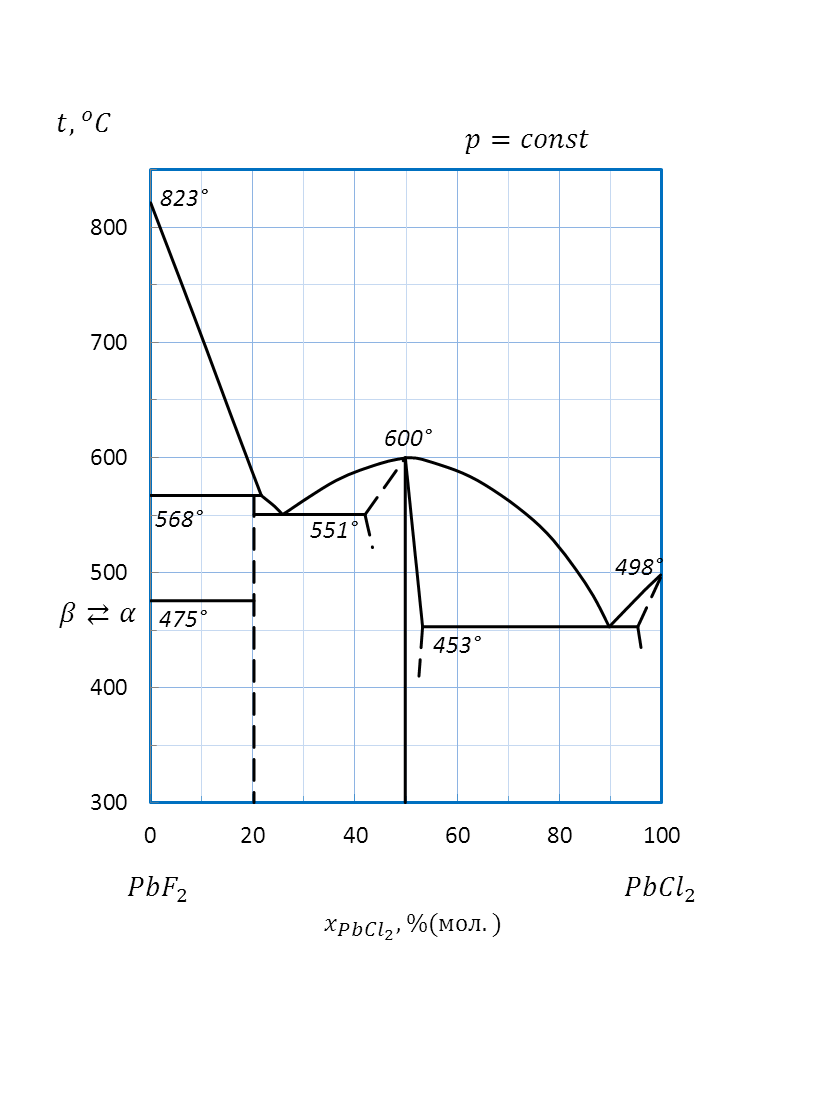
Рисунок 2.62 – Диаграмма состояния системы 

Рисунок 2.63 – Диаграмма состояния системы 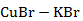
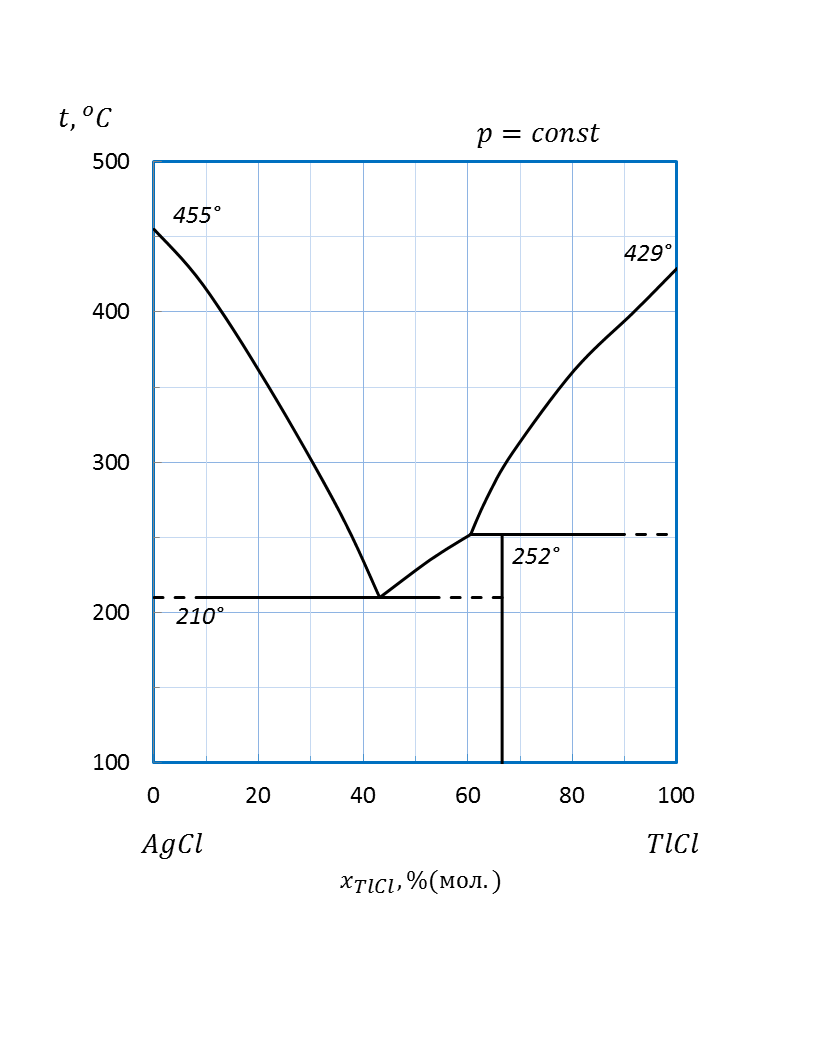
Рисунок 2.64 – Диаграмма состояния системы 

Рисунок 2.65 – Диаграмма состояния системы 

Рисунок 2.66 – Диаграмма состояния системы
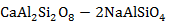
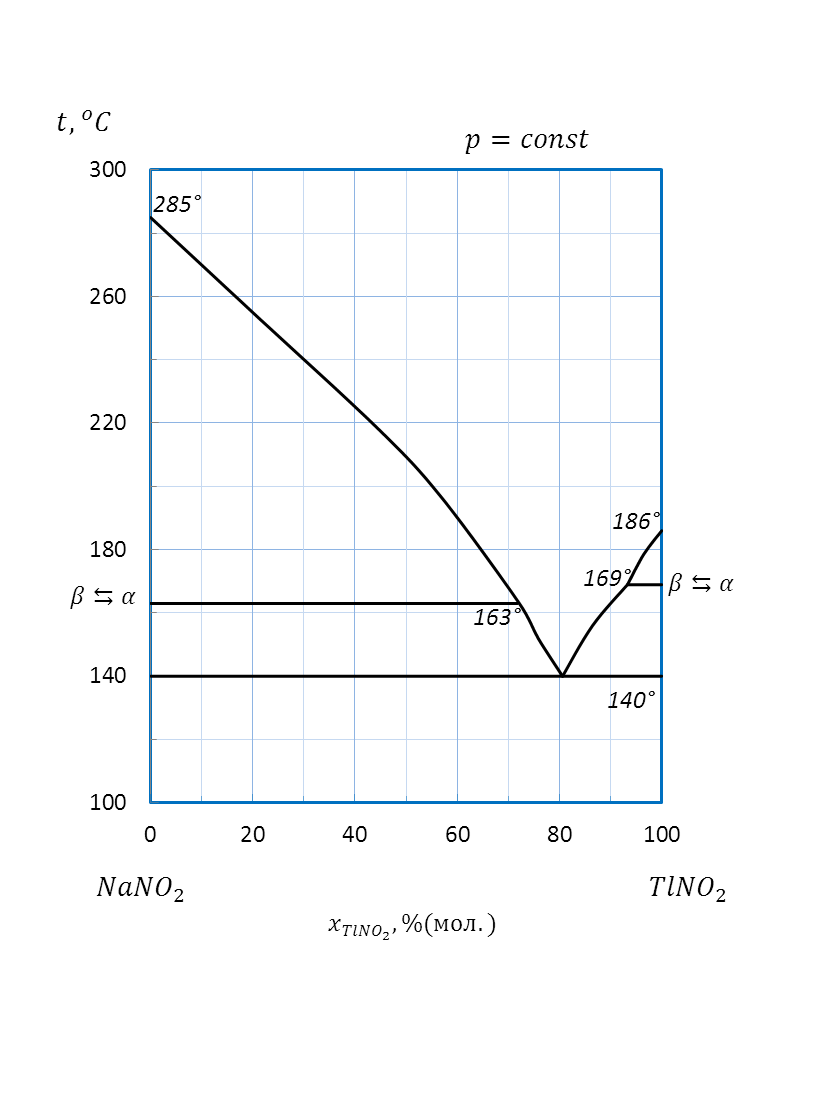
Рисунок 2.67 – Диаграмма состояния системы 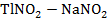

Рисунок 2.68 – Диаграмма состояния системы 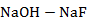

Рисунок 2.69 – Диаграмма состояния системы
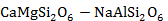
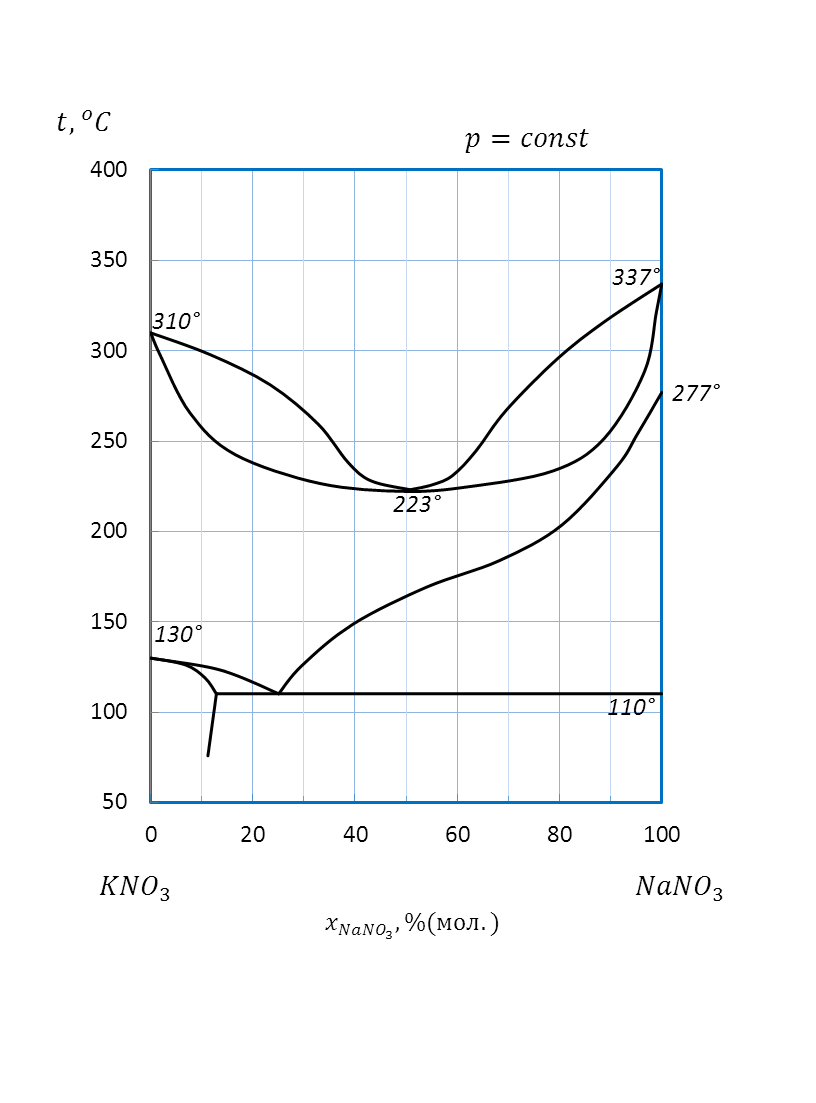
Рисунок 2.70 – Ди
Дата добавления: 2021-01-26; просмотров: 3394;











