Гальванические элементы
Электрохимической системой называется часть пространства, в которой может протекать, по меньшей мере, одна электрохимическая окислительная и одна электрохимическая восстановительная реакции. Примерами электрохимических систем являются гальванические элементы, электролизеры, металлы в растворах электролитов, в том числе в морской и речной воде и во влажной атмосфере воздуха.
Гальванические элементыпредставляют собой электрохимическую систему, состоящую из двух электродов. В электрохимических системах окислительно-восстановительные реакции протекают на поверхности электродов.
Электрод– это система, состоящая из проводника первого рода (с электронной проводимостью) и проводника второго рода (с ионной проводимостью). Проводники первого рода: металлы, некоторые оксиды металлов, графит, пирографит. Проводники второго рода: растворы и расплавы электролитов, твердые электролиты.
Электродный процесс можно представить следующей схемой:
восстановление
Окисленная форма + 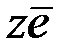 Восстановленная форма
Восстановленная форма
окисление
Совокупность двух указанных процессов приводит к установлению в системе термодинамического равновесия, при котором восстановительный и окислительный процессы протекают с одинаковыми скоростями.
Уравнение равновесной электродной реакции:
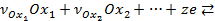
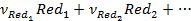 , (3.1)
, (3.1)
где 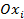 - окисленная форма вещества;
- окисленная форма вещества;
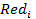 – восстановленная форма вещества.
– восстановленная форма вещества.
В результате протекания этой равновесной реакции на границе металл|раствор возникает двойной электрический слой и устанавливается скачок потенциала, зависящий как от природы металла, так и от концентрации (активности) потенциал-определяющих ионов в растворе.
Истинные (абсолютные) значения электродных потенциалов невозможно ни измерить, ни рассчитать, поэтому эти величины определяют по отношению к выбранному стандарту. За стандарт принят стандартный водородный электрод, потенциал которого принят за ноль. В такой условной водородной шкале потенциалы могут быть измерены экспериментально, а также рассчитаны по уравнению Нернста:
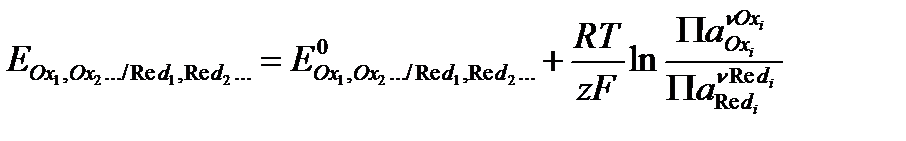 (3.2)
(3.2)
где E0 – стандартный потенциал электрода, В;
R – универсальная газовая постоянная, 8,314 Дж/моль∙К;
T – температура, К;
z – число электронов, участвующих в электродной реакции;
F – число Фарадея, 96485 Кл/моль;
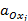 - активность окисленной формы вещества;
- активность окисленной формы вещества;
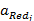 - активность восстановленной формы вещества;
- активность восстановленной формы вещества;
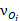 ,
, 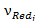 – стехиометрические коэффициенты при окисленной и восстановленной формах вещества в уравнении равновесной электродной реакции.
– стехиометрические коэффициенты при окисленной и восстановленной формах вещества в уравнении равновесной электродной реакции.
Активности индивидуальных простых и сложных веществ принимаются равными единице. Стандартным электродным потенциалом(E0)называется потенциал электрода при активностях окисленной и восстановленной форм вещества, равных единице. Стандартный потенциал дает, как правило, основной вклад в величину электродного потенциала.
Уравнение (3.2) для расчета равновесного потенциала электрода в водородной шкале при 25 °С (298 К) может быть преобразовано:
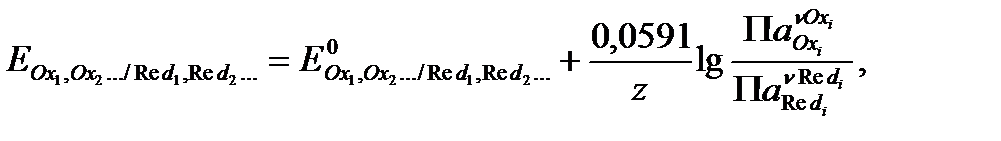 (3.3)
(3.3)
где 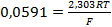 .
.
Электрод принято изображать следующим образом:
Окисленная форма вещества (Ox) |Восстановленная форма вещества ( 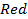 )
)
Например, 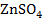 |
| 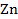 или
или 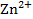 |
| 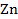 . Граница раздела фаз обозначается вертикальной чертой «|».
. Граница раздела фаз обозначается вертикальной чертой «|».
При схематическом изображении гальванического элемента слева записывается электрод, потенциал которого более отрицателен, справа записывается электрод, потенциал которого более положителен. Схема гальванического элемента должна начинаться и заканчиваться изображением проводника первого рода (металла, графита и др.). Проводники второго рода (растворы или расплавы электролитов, твердые электролиты) разделяются или пористой мембраной или электролитическим мостиком. Мембрана изображается вертикальным пунктиром, а электролитический мостик двумя вертикальными чертами «||». Например, условное изображение медно-цинкового элемента:
(–) Zn | ZnSO4 || CuSO4 | Cu (+),
m1(a±,1) m2(a±,2)
где m1 и m2 – моляльные концентрации растворов электролитов,
a±,1 и a±,2 – средние ионные активности растворов электролитов.
При замыкании электродов гальванического элемента во внешней цепи возникает электрический ток за счет переноса электронов от отрицательного электрода к положительному. Электродвижущей силой (ЭДС), вызывающей появление электрического тока при замыкании внешней цепи, является разность электродных равновесных потенциалов. ЭДС (Е) гальванического элемента может быть рассчитана как:
Е = Е (+) – Е(–) (3.4)
Таким образом, замкнутый гальванический элемент – это электрохимическая система, совершающая полезную электрическую работу Wэл. (Wэл. > 0). Максимальная полезная электрическая работа системы при изотермическом и обратимом проведении процесса определяется величиной ЭДС гальванического элемента:
Wэл., max = zFE (3.5)
Так как Wэл., max > 0, то и ЭДС гальванического элемента Е > 0.
При замыкании электродов гальванического элемента и протекании электрического тока во внешней цепи химическое равновесие на электродах нарушается: на отрицательном электроде в сторону реакции окисления, генерирующей электроны, а на положительном в сторону реакции восстановления, поглощающей электроны. Таким образом, в замкнутом гальваническом элементе происходит направленное самопроизвольное протекание реакций. За счет суммарной самопроизвольной реакции, протекающей в гальваническом элементе и совершается электрическая работа.
Пример: Написать электродные реакции и суммарную реакцию, протекающую в замкнутом медно-цинковом гальваническом элементе:
(–) Zn | ZnSO4 || CuSO4 | Cu (+)
Решение:
На отрицательном цинковом электроде замкнутого медно-цинкового гальванического элемента протекает реакция:
(–): Zn – 2 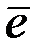 → Zn2+.
→ Zn2+.
На положительном медном электроде замкнутого медно-цинкового гальванического элемента протекает реакция:
(+): Cu2+ + 2 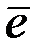 → Cu.
→ Cu.
Уравнение суммарной реакции:
Zn + Cu2+ → Zn2+ + Cu.
Гальванические элементы широко используются как автономные химические источники тока (ХИТ). Однако для практического применения в качестве ХИТ целесообразно использовать только те гальванические элементы, ЭДС которых не менее 1 В.
На использовании гальванических элементов основаны методы потенциометрического исследования растворов электролитов и методы электрохимического анализа.
Дата добавления: 2021-01-26; просмотров: 646;











