А) оксид углерода (II) СО
Строение. В рамках метода валентных связей молекула СО имеет строение :СºО:. Можно считать, что третья связь образована по донорно-акцепторному механизму (кислород — донор электронной пары, углерод — акцептор).
Физиологическое действие. Очень ядовит, смертельная доза СО в воздухе составляет 0,2%. С гемоглобином крови СО связывается прочнее, чем кислород, тем самым блокирует перенос кислорода в организме. Признаки отравления малыми дозами: кровь необычно яркой окраски, сильная головная боль, иногда потеря сознания.
Получение. 1. Сжигание углерода в свободном виде или соединений углерода (кокс, уголь, бензин) при температурах выше 1000 °С и при недостатке кислорода: 2C + O2 = 2CO.
Вследствие протекания этой реакции выхлопные газы автомобильных двигателей обязательно содержат СО; также содержат СО отходящие газы печей при плохой тяге и табачный дым (до 4%).
2. Восстановление диоксида углерода при помощи раскаленного кокса, например, в доменных печах (равновесие Будуара): СО2 + С « 2СО.
3. Восстановление водяного пара раскаленным коксом или другими носителями углерода:
С + Н2О = СО + H2
4. Действие концентрированной серной кислоты на муравьиную кислоту (лабораторный способ): HCOOH 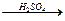 со + н2о.
со + н2о.
Свойства. Бесцветный газ без запаха. По плотности тяжелее воздуха, Сжижается только при очень низких температурах, т. кип. -192°С. На воздухе сгорает (синеватое пламя). Очень мало растворим в воде. Поглощается активным углем, а также твердым фильтрующим слоем, содержащим I2О3.
Химически инертен, однако при участии катализаторов реагирует с кислородом с образованием углеводородов (синтез Фишера — Тропша) или спиртов (синтез метанола). С переходными металлами оксид углерода образует очень летучие, ядовитые и горючие карбонилы, например [Ni(СО)4], [Со2(СО)9], [Fе (СО)5].
Технические газы, содержащие СО. Воздушный газ (генераторный газ) — смесь СО + 2К2. Образуется по экзотермической реакции при газификации угля или кокса с использованием воздуха в специальных генераторах: 2С + О2 + 4N2 = 2СО + 4N2.
Применяют в качестве горючего газа и в синтезе аммиака.
Водяной газ —смесь СО + Н2.
Смешанный газ —это СО, Н2 и N2. Получают при газификации порошкообразного угля смесью водяного пара и воздуха, обогащенного кислородом; аналогичный по составу газ образуется также при риформинге газообразных углеводородов и газификации жидких углеводородов под давлением. Применяют при синтезе аммиака.
Коксовый газ и бытовой газ —смесь Н2, СН4, СО и др. Получают при коксовании угля; при газификации бурого угля (под давлением 2,2 МПа) с помощью водяного пара и кислорода образуется сходный, но более бедный метаном сжатый газ. Применяют в качестве горючего газа.
Б) оксид углерода (IV) СО2
Тривиальное название: углекислый газ.
Распространение в природе. В воздухе содержится 0,03 % (об.). Входит в состав технических горючих газов, вулканических газов, природных (минеральных) вод. Атмосфера Венеры на »95 % состоит из СО2.
Физиологическое действие. Диоксид углерода ассимилируется в процессе фотосинтеза зелеными растениями с помощью имеющегося в них хлорофилла при поглощении солнечной энергии. При этом в растениях образуются органические вещества (в первую очередь — глюкоза), а кислород освобождается и выделяется в атмосферу. Поглощенная энергия при диссимиляции в организмах животных и растений снова высвобождается, этим замыкается элементарный цикл развития живого организма. Диссимиляция органических веществ в организмах — это процесс их окисления с помощью усвоенного при дыхании кислорода в присутствии ферментов с образованием диоксида углерода и воды:
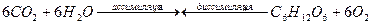
Из всей падающей на Землю солнечной энергии »0,12 % фотохимически усваивается растениями. Зеленые листья площадью 1 м2 за время освещения Солнцем в течение 1 ч производят из СО2 1 г виноградного сахара.
Известно, что люди выдыхают воздушную смесь, содержащую 4 % СО2. Чистый СО2 действует удушающее, при содержании в воздухе 15% СО2 возникает головокружение, а иногда возможна потеря сознания.
Получение.
1. Полное сгорание кокса: С + О2 == СО2
Для очистки СО2 от примесей газ пропускают через раствор К2СO3 иа холоду, СО2 поглощается и в результате в растворе образуется КНСО3. Примеси проходят через раствор, а СО2 выделяют из раствора кипячением (термическое разложение гидрокарбоната).
2. Обжиг известняка и других карбонатов: СаСО3 = СаО + СО2
3. Обработка карбонатов (например, мрамора) сильной кислотой:
СаСО3 + 2НС1 = СаС12 + Н2О + СО2
4. Спиртовое брожение: С6Н12О6 = 2С2Н5ОН + 2СО2.
Физические свойства. Бесцветный газ со слабым кислым вкусом и запахом, в 1,5 раза тяжелее воздуха. Его можно «переливать» из сосуда в сосуд; обычно собирается на дне подвалов, колодцев и пещер. СО2 — негорючий газ (гасит пламя). Достаточно хорошо растворим в холодной воде, особенно под давлением.
При 20 °С под давлением 5 МПа (» 50 атм) диоксид углерода сжижается.
Жидкий СО2 хранят в стальных баллонах. При отборе из баллона газообразного СО, часть жидкости испаряется и давление в системе поддерживается постоянным до тех пор, пока в баллоне не израсходуется вся жидкость. Поэтому остаток СО2 в баллоне нельзя определить по манометру (расход СО2 находят по изменению массы баллона). При вытекании жидкого СО2 из баллона (в наклонном состоянии) происходит мгновенное испарение газа при быстром охлаждении и часть жидкости замерзает, образуя снегообразную массу. Спрессованный твердый СО2 (сухой лед) используется для временного поддержания охлажденного состояния продуктов; сухой лед не плавится, а сублимирует при -78 °С. Смесь сухого льда с ацетоном используется в лаборатории как охлаждающая смесь до температуры -90 °С.
Химические свойства. Диоксид углерода с водой образует угольную кислоту (см. ниже); с основными гидроксидами — карбонаты и гидрокарбонаты (на этом основано затвердевание известкового строительного раствора). Восстанавливается магнием до углерода:
СО2 + 2Мg = С +MgO
Обнаружение. По помутнению водного раствора гидроксида бария (или кальция) при контакте с СО2: Ва(ОН)2 + СO2 = ВаСО3 + Н2О.
Газ пропускают через баритовую (или известковую) воду или над каплей этой воды, помещенной на часовое стекло.
Применение. Диоксид углерода используется для промышленного синтеза карбамида, салициловой кислоты и других химических продуктов; в огнетушителях; как инертная среда для хранения легковоспламеняющихся жидкостей, для сварки в атмосфере этого газа, для отверждения содержащей воду формовочной земли, для приготовления газированных напитков, как охлаждающий агент (сухой лед и его смеси).
В) Угольная кислота Н3СО3 и ее соли
Угольная кислота в чистом виде не получена, хотя молекулы состава Н2СО3 существуют в газовой форме и в водном растворе. В водном растворе имеет место равновесие:
со2 + н2о « н2со3 « н+ + нсо3- « 2н+ + со32-
Этим объясняются кислотные свойства Н2СО3. При комнатной температуре равновесие сильно смещено в направлении образования СО2 и Н2О, и в связанном состоянии оказывается только 1 % молекул СО2 и Н2О, причем большая часть продукта имеет полигидратный состав СО2*nН2О, а не Н2СО3. Полигидрат обладает очень слабыми кислотными свойствами, а Н2СО3 — кислота средней силы, но так как содержание Н2СО3 в растворе мало, то в целом кислотность такого раствора весьма мала. Полигидрат СО2*nН2О и молекулы Н2СО3 термически неустойчивы, поэтому при подкислении растворов карбонатов выделяется СО2. Вместе с тем при пропускании диоксида углерода через растворы солей более слабых кислот последние могут быть выделены в свободном виде или в виде кислотных оксидов (SiO2, НСN, С6Н5ОН и др.).
Соли (и эфиры) угольной кислоты называются карбонатами. Существуют средние карбонаты с анионом СО32- и кислые карбонаты с анионом НСО3- (гидрокарбонат-ион, ранее назывался бикарбонат-ион).
Наибольшее практическое значение имеют карбонат натрия Nа2СО3 (тривиальное название кальцинированная сода) и его кристаллогидрат Nа2СО3*10Н2О (сода), гидрокарбонат натрия NаНСО3 (натрон, питьевая сода), карбонат калия К2СО3 (поташ), гидроксид-карбонат свинца (II) 2РbСO3•Рb(ОН)2 (свинцовые белила).
Карбонаты при нагревании разлагаются на оксид металла и диоксид углерода, например:
СuСО3 = СuО + СО2
Чем сильнее основные свойства оксида металла, тем выше температура разложения соответствующего карбоната. Карбонат алюминия А12(СО3)3 полностью неустойчив уже при комнатной температуре.
При подкислении растворов карбонатов или при обработке твердых карбонатов сильными кислотами неустойчивая в свободном виде угольная кислота выделяется в виде соответствующего ей оксида СО2, например:
Nа2СО3 + 2НС1 = 2NаС1 + Н2О + СО2, СаСО3 + 2НNO3 = Са(NО3)2 + Н2О + СО2
Способ обнаружения карбонатов основан на обработке их сильной кислотой и последующем пропускании отходящего газа через баритовую воду.
Карбиды — это соединения между углеродом и более электроположительными (более металличными) элементами. Существуют карбиды, которые при гидролизе чистой или подкисленной водой образуют углеводороды. Так, карбид кальция СаС2 выделяет ацетилен С2Н2, а карбид алюминия А14С3 — метан СН4:
СаС2 + 2Н3О+ = Са2+ + 2Н2О + С2Н2, А14С3 + 12Н2О = 4А1(ОН)3 + 3СН4
Известны взрывоопасные, термически малоустойчивые карбиды, такие как карбид серебра Аg2С3 и меди Сu2С2, они разлагаются на металл и уголь. Особой твердостью отличаются карбид бора В4С, карбид кремния SiС и карбид вольфрама W2С. Карбид железа Fе3С (цементит) является компонентом железоуглеродных сплавов (сталь, чугун).
Дата добавления: 2021-09-07; просмотров: 763;











