ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химическая термодинамика– раздел физической химии, где изучаются взаимные превращения различных форм энергий в ходе химических реакций, а также определяется принципиальная возможность, направление и предел самопроизвольного протекания процессов в заданных условиях.
Термохимия– раздел химической термодинамики, в котором объектом изучения являются тепловые эффекты процессов, теплоёмкости веществ и другие, связанные с ними величины. Основная задача термохимии заключается в прямом или косвенном определении (путём измерений или вычислений) тепловых эффектов химических реакций и различных физико-химических процессов (например, фазовых, агрегатных превращений). Другой важной задачей термохимии является изучение теплоёмкости веществ. Экспериментальным методом термохимии служит калориметрия.
Термохимические данные и выявленные закономерности используются для расчетов тепловых балансов химико-технологических процессов и выбора (сочетании с другими термодинамическими характеристиками) оптимальных условий их проведения. Термохимические исследования позволяют связать энергетические характеристики веществ с их составом, строением и реакционной способностью.
Термодинамическая система– совокупность тел (веществ), находящихся во взаимодействии и отделенных от окружающей среды условной (воображаемой) или реальной границей (поверхностью раздела). В химической термодинамике рассматриваются только макроскопические системы, состоящие из очень большого числа частиц - поскольку только к этим системам применимы такие понятия как: температура, давление, теплота и некоторые другие. Взаимодействие системы с окружающей средой может происходить путём обмена энергией (механической, тепловой и др.) и веществом.
Открытая система– система, которая обменивается с окружающей средой и веществом, и энергией.
Закрытая система– система, которая обменивается с окружающей средой только энергией. В такой системе отсутствует обмен веществом с окружающей средой.
Изолированная система– система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Состояние системы– совокупность всех физических и химических свойств системы, таких как масса, объем, давление, температура, химический состав, и др.
Параметры состояния– свойства системы, которых оказывается достаточно для однозначной характеристики её состояния. Основные параметры состояния: температура (T), давление (p), объем (V), количество вещества (n), концентрации веществ (х, с) в системе. Для системы не обязательно знать все параметры состояния, если они взаимосвязаны.
Термодинамический процесс– процесс, в котором происходит изменение параметров состояния системы.
Изотермический процесс– процесс, протекающий при неизменной температуре (T = const).
Изобарный процесс– процесс, протекающий при постоянном давлении (p = const).
Изохорный процесс– процесс, протекающий при постоянном объеме (V = const).
Стандартные условия– давление 101325 Па. Для термодинамических функций, стандартные условия указываются надстрочным индексом “0”. Например, 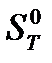
Обратимый (или квазистатический) процесс- процесс, который осуществляется таким способом, что имеется возможность возвращения системы в исходное состояние через те же самые промежуточные квазиравновесные состояния, которые он проходил в прямом направлении, и при этом ни в самой системе, ни в окружающей среде не останется никаких стойких изменений. Термодинамическое понятие обратимого процесса не связано с направлением реакции (процесса), оно лишь указывает на определенный способ проведения реакции (процесса).
Экстенсивное свойство– свойство, которое зависит от количества вещества. Например, масса, объём, теплоемкость, энтропия и т.д.
Интенсивное свойство– свойство, которое не зависит от количества вещества. Например, плотность, удельная теплоёмкость и т.п.
Функции состояния– термодинамические свойства системы, изменение которых при переходе из одного состояния системы в другое зависит только от её начального и конечного состояния и не зависит от пути (способа) перехода.
Функции процесса– термодинамические свойства системы, изменение которых при переходе из одного состояния системы в другое зависит от пути (способа) перехода.
Внутренняя энергия(U) – функция состояния, которая характеризует общий запас энергии системы и включает в себя все виды энергий движения и взаимодействия всех частиц, составляющих систему: атомов, ядер, электронов, молекул и др.
Работа(W)– макроскопическая форма передачи энергии от одной системы к другой, в форме кинетической энергии направленного (упорядоченного) движения частиц. Работа является функцией процесса.
Теплота(Q)– микроскопическая, неупорядоченная, форма передачи энергии хаотически двигающимися частицами. Направление передачи теплоты определяется температурой. Теплота является функцией процесса. Понятия теплоты и работы применимы только к процессам, но не к состоянию системы.
Тепловой эффект химической реакции– количество тепла, которое выделяется или поглощается при необратимом проведении реакции в условиях, когда температуры исходных веществ и продуктов реакции одинаковы, давление или объем постоянны (p = const или V = const).
Экзотермическая реакция– реакция, идущая с выделением тепла.
Эндотермическая реакция– реакция, идущая с поглощением тепла.
Идеальный газ– газ, в котором взаимодействие между молекулами, а также их размеры по сравнению с расстояниями между частицами пренебрежимо малы. Идеальный газ - это предельное состояние реальных газов при бесконечно малом давлении. Термином «идеальный газ» обозначается газ, свойства которого описываются законами идеальных газов.
Уравнение состояния– уравнение, связывающее параметры состояния. Для идеального газа параметры состояния связаны уравнением Менделеева-Клапейрона:
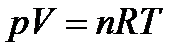
| (1.1) |
Теплоемкость системы– отношение количества сообщенной системе теплоты к наблюдаемому при этом повышению температуры. При этом предполагается, что нагревание не сопровождается: химическими превращениями, переходом вещества из одного агрегатного или фазового состояния в другое, совершением полезной работы.
Средняя теплоемкость( 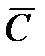 ) – количество теплоты, необходимое для нагревания системы на один градус (Кельвин).
) – количество теплоты, необходимое для нагревания системы на один градус (Кельвин).
Истинная теплоемкость (C) – количество теплоты, необходимое для нагревания системы на бесконечно малую величину температуры. Истинная теплоемкость равна производной теплоты по температуре.
Изобарная теплоемкость (Cp)– отношение количества сообщенной при постоянном давлении (p = const) теплоты к наблюдаемому при этом повышению температуры системы.
Изохорная теплоемкость (CV)– отношение количества сообщенной при постоянном объеме (V = const) теплоты к наблюдаемому при этом повышению температуры системы.
Удельная теплоемкость– теплоемкость, рассчитанная на единицу массы вещества (кг или г).
Молярная теплоемкость– теплоемкость, рассчитанная на единицу количества вещества (моль).
Начала термодинамики– законы термодинамики, которые нельзя вывести из других более общих законов. Начала термодинамики являются постулатами. Однако, их можно считать твердо установленными фундаментальными законами природы, поскольку многовековой житейский, производственный и научный опыт человечества показал, что процессы, противоречащие этим постулатам, никогда не наблюдаются. На основании этих постулатов логическим путем выводятся многие другие закономерности, связывающие различные макроскопические свойства веществ.
Дата добавления: 2021-01-26; просмотров: 574;











