Лекция 9. Влияние поверхностных сил на процесс образования сварного соединения.
Первичная кристаллизация металла.
Переход металла из жидкого состояния в твердое сопровождается перегруппировкой атомов из неупорядоченного их расположения в упорядоченное, закономерное, определяемое кристаллической решеткой. Процесс образования кристаллов в металле при его затвердевании называется кристаллизацией. Как установил еще Д. К. Чернов, кристаллизация состоит из двух элементарных, одновременно протекающих процессов:
1) зарождения зародышей, или центров кристаллизации;
2) роста кристаллов из этих центров.
Первоначально вырастают оси кристаллов, характеризующиеся симметрией 1,2-го и последующих порядков. Затем заполняются межосевые пространства и образуются кристаллы, «скелет» которых имеет дендритное, или древовидное, строение. На основе этих общих представлений сложились две теории кристаллизации металлов — непрерывной и периодической кристаллизации.
Теория непрерывной кристаллизации разработана Г. Тамманом на основе исследований кристаллизации органических веществ при различных температурах. Г. Тамман установил, что при переохлаждении жидкого расплава в нем самопроизвольно зарождаются центры кристаллизации и начинается рост кристаллов. В связи с этим скорость кристаллизации определяется как числом центров (ч. ц.) кристаллизации, зарождающихся в единицу времени, так и линейной скоростью роста кристаллов (с. к.) в единицу времени. Соотношение этих величин определяет размер образующихся кристаллов.
При переохлаждении п = 0 (рис. 9.1) значения ч. ц. и с. к. также равны нулю, т. е. кристаллизация невозможна из-за отсутствия переохлаждения. С появлением небольшого переохлаждения ч. ц. и с. к. вначале возрастают. Здесь положению I отвечает относительно небольшое число центров при максимуме скорости роста кристаллов. В этом случае следует ожидать образования немногочисленных, но крупных кристаллов. Значительному переохлаждению жидкости в положении II отвечает максимальное число центров кристаллизации ч. ц., но относительно малая скорость роста кристаллов с. к. Тогда будет образовываться мелкое зерно.
Теория непрерывной кристаллизации Г. Таммана предполагает спокойное затвердевание жидкости — без перемешивания жидкого металла внутренними конвективными потоками, при равномерном распределении температур в кристаллизующемся объеме, тогда как в действительности таких условий обычно не бывает. Следовательно, теория непрерывной кристаллизации имеет ограниченное применение для реальных жидких металлов.
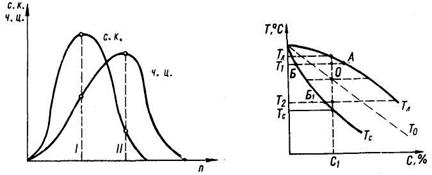
Рис. 9.1. Графики зависимости скорости роста кристаллов (с. к.) и числа центров кристаллизации (ч. ц.) от величины переохлаждения n.
Рис. 9.2. Часть диаграммы состояния сплавов, образующих непрерывный ряд твердых растворов.
Теория периодической кристаллизации развита в работах советских ученых школы акад. Н. Т. Гудцова. Согласно этой теории кристаллизация металлов протекает с остановками вследствие периодического выделения скрытой теплоты кристаллизации, приостанавливающей равномерное течение процесса. Поскольку кристаллы растут с некоторыми остановками т.е. слоями, центрами кристаллизации для каждого последующего слоя становятся различные неровности на поверхности предыдущего слоя.
Процесс кристаллизации имеет известную направленность: кристаллы растут в направлении, обратном теплоотводу, в глубь жидкости, причем внешняя форма их зависит от условий соприкосновения друг с другом.
В современных представлениях о кристаллизации сплавов особая роль отводится диффузионным процессам. Возьмем для примера сплав концентрации С1 (рис. 9.2). При его переохлаждении от Тл до Т1 в жидкой фазе образуются зародыши твердой фазы, в которой растворённый элемент содержится в количестве, определяемом линией солидуса Тс при температуре T1, т. е. точкой Б.
Рис. 9.3 Схематическое изображение продольного сечения сварочной ванны первого типа.
Непосредственно окружающая твердую фазу жидкость будет обогащаться растворенным элементом. Содержание его при температуре Т1, определится положением линии ликвидуса ТЛ, т. е. точкой А.
При температуре Т1 на поверхности раздела жидкой и твердой фаз установятся известные граничные равновесные концентрации. Вследствие разности концентраций растворенного элемента в твердой и окружающей ее жидкой фазе равновесие может нарушаться за счет диффузионных процессов, конвекции. При этом растворенный элемент будет перемещаться в глубь жидкости. Тогда соответствующая часть атомов основного металла для восстановления равновесия перейдет из жидкой фазы в твердую, что приведет к дальнейшему развитию кристаллизации. Развивающуюся кристаллизацию принято называть избирательной, или диффузионной.
Возможен и другой механизм кристаллизации. На том же рис. 9.2 показана линия То, характеризующая равенство термодинамических потенциалов жидкой и твердой фаз одинакового состава. При температуре ниже То термодинамический потенциал твердой фазы будет меньше соответствующего потенциала жидкой фазы. Поэтому после переохлаждения жидкого сплава концентрации С1 до температуры Т2 начнется интенсивный рост твердой фазы за счет присоединения любых атомов, находящихся в контакте с твердой фазой — атомов примеси или металла. В твердой фазе (точка Б1) при температуре Т2 содержание растворенного элемента будет примерно то же, что и в жидкой фазе исходного состава.
Дата добавления: 2016-10-26; просмотров: 1828;











