Квантовая физика и физика атома.
Тема 28. Атомная физика
До конца ХIХ века считалось, что атомы – мельчайшие неделимые частицы вещества. Но открытие электрона показало, что эта отрицательно заряженная частица почти в 2000 раз легче атома и входит в состав любых атомов.
При различных процессах атомы теряют электроны и превращаются в положительно заряженные ионы. Это означает, что атомы – сложные образования и состоят из положительно заряженных частиц и электронов. Как распределены эти частицы в атоме – было не известно.
Первая модель строения атома принадлежит Дж.Томсону(1903 г.). По этой модели, атом представляет собой равномерно заполненный положительным электричеством шар, внутри которого находится электрон. Суммарный положительный заряд шара равен заряду электрона, так что атом в целом нейтрален. Данная модель оказалась несостоятельной, так как не соответствовала многим экспериментальным фактам.
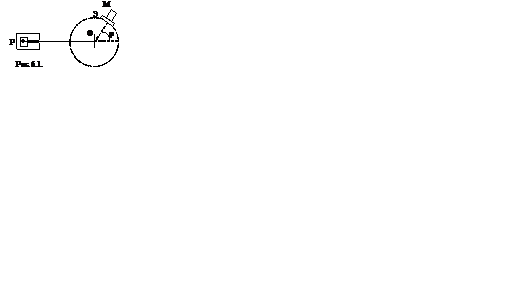 В 1910-1911 гг. Э.Резерфорд с сотрудниками провел опыты по зондированию атомов с целью выяснения характера распределения положительных и отрицательных зарядов в атоме. Для этого узкий пучок a - частиц, испускаемых радиоактивным веществом Р, направлялся на тонкую металлическую фольгу Ф, за ней помещался экран Э, который был покрыт сернистым цинком и при соударение с a-частицами экран светился. Вызываемые ударами a-частиц вспышки света наблюдались в микроскоп М. Микроскоп и экран можно было вращать вокруг оси, проходящей через центр рассеивающей фольги.
В 1910-1911 гг. Э.Резерфорд с сотрудниками провел опыты по зондированию атомов с целью выяснения характера распределения положительных и отрицательных зарядов в атоме. Для этого узкий пучок a - частиц, испускаемых радиоактивным веществом Р, направлялся на тонкую металлическую фольгу Ф, за ней помещался экран Э, который был покрыт сернистым цинком и при соударение с a-частицами экран светился. Вызываемые ударами a-частиц вспышки света наблюдались в микроскоп М. Микроскоп и экран можно было вращать вокруг оси, проходящей через центр рассеивающей фольги.
Напомним, a-частицы – это частицы, которые испускаются некоторыми радиоактивными элементами. Они обладают положительным зарядом, равным удвоенному элементарному заряду и движутся со скоростью 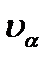 =107 м/с, поэтому обладают большой проникающей способностью.
=107 м/с, поэтому обладают большой проникающей способностью.
Опыты показали, что a-частицы, пролетая через фольгу, рассеивались на разные углы. В некоторых случаях угол рассеивания j превышал 900. Объяснить это можно было взаимодействием a - частиц с положительным зарядом атома. Причем этот заряд должен занимать малый объем и обладать большой массой. На основании этих опытов Резерфорд предложил ядерную модель строения атома. Согласно Резерфорду атом представляет собой систему зарядов, в центре которой расположено тяжелое положительное ядро с зарядом Ze, имеющей размеры, не превышающие 10-14 м, а вокруг ядра расположены Z электронов, распределенных по всему объему, занимаемому атомом. Почти вся масса атома сосредоточена в ядре.
Однако ядерная модель оказалась в противоречии с законами классической механики и электродинамики. Поскольку система неподвижных зарядов не может находиться в устойчивом состоянии, Э.Резерфорду пришлось отказаться от статической модели атома и предположить, что электроны движутся вокруг ядра, описывая искривленные траектории. Но в этом случае электрон будет двигаться с ускорением, в связи с чем, согласно классической электродинамике, он должен непрерывно излучать электромагнитные (световые) волны и иметь сплошной спектр излучения. Процесс излучения сопровождается потерей энергии, так что электрон должен, в конечном счете, упасть на ядро. Из опыта известно, что атом – это устойчивые образования, а спектр их излучения линейчатый, а не сплошной.
Постулаты Бора.
Для объяснения противоречий модели строения атома опытным фактам датский физик Нильс Бор в 1913 г. обобщил гипотезу Планка для любой атомной системы, положив тем самым начало развитию квантовой теории строения атома. В основе теории Бора лежат два постулата:
I. Атомы и атомные системы могут длительное время находиться в определенных состояниях, называемых стационарными, при этом атом не излучает и не поглощает энергию. Энергии стационарных состояний образуют дискретный ряд Е1, Е2, Е3,…
II. Атомы излучают или поглощают энергию при переходе из одного стационарного состояния в другое, при этом квант излучаемой или поглощаемой энергии определяется соотношением: hv=En–Em , где En , Em – энергии стационарных состояний, между которыми произошел переход.
Дата добавления: 2016-10-26; просмотров: 1682;











