Первый закон термодинамики. Энтальпия
Для замкнутых систем, способных обмениваться энергией с окружающей средой, I закон термодинамики имеет вид
Q = δU + A,
где Q – энергия, полученная системой из окружающей среды;
δU – изменение внутренней энергии системы;
А – совершаемая системой работа.
Внутренней энергией называется вся энергия, заключенная в веществе. Она складывается из кинетический и потенциальной форм движения. Часто внутреннюю энергию делят на две части, одна из которых зависит, а другая – не зависит от температуры
U = U(T) + Uo .
Эксперимент и теория не позволяет выделить все виды энергии в веществе, поэтому в термодинамике оперируют с ее превращениями.
Для бесконечно малых изменений системы запишем
δQ = dU +δA.
При изобарическом процессе (р – const)
δQ = dU + рδV.
Энергия перехода из состояния 1 в состояние 2 равна
Q1-2 = (U2 + рV2) – (U1 + рV1).
Выражения в скобкам примем за новую термодинамическую функцию – энтальпию, которая равна энергии, необходимой для перевода системы в данное состояние. Изменение энергии можно представить как разность энтальпий
Q1-2 = Н2 – Н1 = δН.
Рассмотрим изменение энтальпии для 1-ого моля вещества с ростом температуры, причем возможны фазовые превращения

0 Тα↔β Тпл Ткип
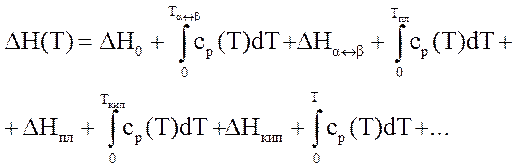
где δНо – энтальпия вещества при 0оК;
ср – теплоемкость при постоянном при постоянном давлении, зависит от температуры.
Для практических расчетов ср применяются эмпирические формулы
ср = а + bT + cT2 + dT –2.
Коэффициенты a, b, c, d известны из справочной литературы.
При практических расчетах нет необходимости пользоваться абсолютными значениями энтальпий, отсчитываемых от 0оК. Часто устанавливается стандартный отсчет, т.к. в большинстве случаев требуется стандартная разность энтальпий, равная разности энтальпий при стандартных условиях и абсолютном нуле.
Стандартные условия – 25оС и 760 мм р.с. (1,013· 105 Па).
Стандартные энтальпии приводятся в справочниках для 1 моля вещества. Для упрощения расчетов используются следующие допущения:
1. Стандартные энтальпии для простых веществ, устойчивых при стандартных условиях , принимаются равными нулю.
Пример –  .
.
2. Стандартные энтальпии для сложных веществ равны тепловому эффекту реакции их образования из простых с обратным знаком. Для экзотермических реакций δНо <0, для эндотермических – δНо > 0.
В настоящее время данные по тепловому эффекту реакции не приводятся, а даются разности энтальпий. По ним можно вычислить разности энтальпий реакции, при этом из разности энтальпий конечных вычитаются разности энтальпий исходных продуктов.
Пример
С2Н2 + 5/2 О2 ↔ 2СО2 + Н2О.
200 0 -300 -285
δН = (-300·2 – 285) – (200 + 5/2·0) = – 1085.
Значительный тепловой эффект.
Для многих веществ разности энтальпий приведены также для условий, отличных от стандартных.
Дата добавления: 2016-10-26; просмотров: 1922;











