ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА
Образование аммиака из азота и водорода протекает на катализаторе при высоких давлениях и температурах по уравнению:
ЗН2 + N2 ↔ 2NH3+ Q
Эта реакция обратима, протекает со значительным уменьшением объема (из четырех объемов водорода и азота получают два объема аммиака) и с выделением большого количества тепла. По принципу Ле-Шателье при повышении давления и понижении температуры равновесие реакции синтеза аммиака будет сдвигаться в сторону образования аммиака. При повышении давления и постоянной температуре равновесное содержание аммиака в смеси с азотом и водородом увеличивается. При известных значениях константы равновесия Кр для азотоводородной смеси стехиометрического состава, пользуясь уравнением:
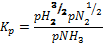
можно определить равновесные концентрации аммиака при различных температурах.
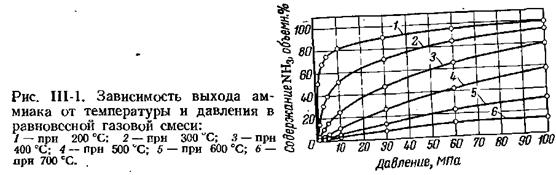
На рис. Ш-1 приведена зависимость выхода аммиака от давления и температуры равновесной газовой смеси. Если состав азотоводородной смеси, поступающей на синтез аммиака, отличается от стехиометрического, равновесные концентрации аммиака резко снижаются. Этим объясняется необходимость получения в промышленных условиях азотоводородной смеси стехиометрического состава.
В азотоводородной смеси, получаемой на промышленных установках, присутствуют так называемые инертные примеси — метан и аргон, которые не вступают в реакцию, но разбавляют азотоводородную смесь и соответственно снижают равновесную концентрацию аммиака, как это показано ниже для давления 29,4 МПа и температуры 500 °С:
Содержание инертных примесей, % ....... 0 5 10 20
Равновесная концентрация аммиака, %...... 26,4 24,0 21,6 17,7
Тепловой эффект реакции синтеза аммиака зависит от давления и температуры процесса. Ниже приведены значения теплового эффекта при различных давлениях и при температуре 500°С:
Дата добавления: 2016-10-26; просмотров: 3327;











