Конверсия метана. Классификация и химизм процессов.
Конверсия водяным паром.Равновесный состав газовой смеси определяется такими параметрами процесса, как температура и давление в системе, а также соотношением реагирующих компонентов.
При атмосферном давлении и стехиометрическом соотношении исходных компонентов достаточно полная конверсия метана достигается при температурах около 800 °С. При увеличении расхода водяного пара такой же степени разложения метана можно достичь при более низких температурах. Применение давления существенно снижает полноту конверсии. Так, при давлении 3 МПа достаточно полная конверсия наблюдается лишь при температуре около 1100°С.
В современных установках при давлении 2 МПа и выше при соотношении СН4 : Н20 —1:4 остаточное содержание метана после паровой конверсии составляет 8—10%. Для достижения остаточного содержав я СН4 около 0,5% конверсию ведут в две стадии: паровая конверсия под давлением (первая стадия) и паровоздушная конверсия с использованием кислорода воздуха (вторая стадия). При этом получается синтез-газ стехиометрического состава и отпадает необходимость в разделении воздуха для получения технологического кислорода и азота.
Конверсия метана кислородом.Для получения водорода конверсией метана кислородом необходимо провести процесс по реакции неполного окисления метана. Реакция протекает в две стадии:
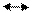 1) СН4+0.5О2 СО + 2Н2; ΔН=—35,6кДж
1) СН4+0.5О2 СО + 2Н2; ΔН=—35,6кДж
 СН4 + 202
СН4 + 202 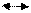
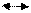 С02+2Н20; ΔН = —800 кДж
С02+2Н20; ΔН = —800 кДж
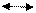 2) СН4+Н20 СО +ЗН2; ΔН = 206,4кДж
2) СН4+Н20 СО +ЗН2; ΔН = 206,4кДж
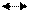 СН4-+С02 2СО+ 2Н2; ΔН = 248кДж
СН4-+С02 2СО+ 2Н2; ΔН = 248кДж
Значения констант равновесия реакций первой стадии настолько велики, что эти реакции можно считать практически необратимыми. В связи с этим повышение концентрации кислорода в газовой смеси сверх стехиометрического не приводит к увеличению выхода продуктов.
Повышение давления при конверсии кислородом, как и при конверсии водяным паром, термодинамически нецелесообразно; чтобы при повышенных давлениях добиться высокой степени превращения метана, необходимо проводить процесс при более высоких температурах.
Рассмотренные процессы конверсии метана водяным паром и кислородом протекают с различным тепловым эффектом: реакции паровой конверсии эндотермические, требуют подвода теплоты; реакции кислородной конверсии экзотермические, причем выделяющейся теплоты достаточно не только для автотермического осуществления собственно кислородной конверсии, но и для покрытия расхода теплоты на эндотермические реакции паровой конверсии. Поэтому конверсию
метана целесообразно проводить со смесью окислителей.
Парокислородная, парокислородовоздушная и паровоздушная конверсия метана.Автотермический процесс (без подвода теплоты извне) может быть осуществлен путем сочетания конверсии метана в соответствии с экзотермической реакцией (IV) и эндотермической (V). Процесс называется парокислородной конверсией, если в качестве окислителей используют водяной пар и кислород, и парокислородовоздушной, если в качестве окислителей используют водяной пар, кислород и воздух.
Как тот, так и другой процесс нашли применение в промышленной практике. При проведении парокислородной конверсии получают безазотистый конвертированный газ, при проведении парокислородовоздушной конверсии — конвертированный газ, содержащий азот в таком количестве, которое необходимо для получения стехиометрической азотоводородной смеси для синтеза аммиака, т. е. 75% водорода и 25% азота.
Дата добавления: 2016-10-26; просмотров: 9200;











