Дефекты закрытия неврально трубки
Наиболее частую форму врожденной аномалии центральной нервной системы представляют анэнцефалия и (или) spina bi-fida, которые принято обозначать общим названием dysraphia neuralis или дефекты закрытия невральной трубки (ДЗНТ). Выделение этой аномалии объясняется не только ее распространенностью, но и возможностями пренатальной диагностики (распознавание с большой долей вероятности до 20-й недели беременности). Биохимические аспекты патогенеза неизвестны, поэтому специфическая пренатальная диагностика ДЗНТ не представляется возможной.
В настоящее время существуют 2 метода исследования, облегчающие пренатальную диагностику: определение уровня альфа-фетопротеина (АФП) в амниотической жидкости и исследование клеток в ней; прямое ультразвуковое исследование. Эффективность каждого из методов зависит в первую очередь от технических условий. При соблюдении определенных условий лучший результат достигается одновременным применением обоих методов.
В наши дни как определение АФП, так и ультразвуковая диагностика являются неотъемлемыми методами исследования в пренатальных центрах, с их помощью удается предупредить повторение ДЗНТ почти во всех случаях (ретроспективная профилактика), а благодаря организации проспективных профилактических осмотров можно предупредить примерно 70—80% всех случаев ДЗНТ.
Альфафетопротеин известен не так давно. Иммунологически идентичный белок был, обнаружен и при некоторых опухолевых заболеваниях, поэтому исследование АФП получило широкое распространение в первую очередь в онкологической практике.
Молекулярная масса АФП 61000—75000; в отношении электрофореза он соответствует aльфа-глобулину. По своим физическим свойствам АФП очень схож с альбумином, оказывает нецитотоксическое иммуносупрессивное действие, угнетая некоторые функции Т-клеток. Вполне вероятно, что иммунорегуляторная активность АФП оказывает защитное действие на плод, о чем свидетельствует следующий факт: введение беременным животным анти-АФП-сыворотки может вызвать выкидыш и аномалии развития. В последнее время некоторые авторы считают вероятной роль АФП в защите развивающегося мозга плода от материнских эстрогенов.
АФП можно обнаружить в амниотической жидкости уже на 6-й неделе беременности (его концентрация составляет 1,5 мкг/мл). В последующем кривая концентрации АФП в амниотической жидкости схожа с кривой его уровня в сыворотке крови плода, однако количество его в сыворотке значительно меньше (примерно в 100 раз). Наиболее высокая концентрация АФП в амниотической жидкости отмечается на 12—14-й неделе беременности (в среднем около 30 мкг/мл), затем она резко уменьшается и на 20-й неделе составляет лишь 10 мкг/мл.
Удалось установить также, что содержание АФП в амниотической жидкости не является специфическим признаком ДЗНТ. Содержание АФП может быть повышенным и при ряде других аномалий развития, а также при осложненной беременности. Пока не совсем выяснены вопросы, когда и почему увеличивается содержание АФП в амниотической жидкости, насколько чувствителен метод исследования и в какой степени этот признак характерен для ДЗНТ. Поскольку содержание АФП в сыворотке крови плода с ДЗНТ не повышено, кажется наиболее вероятным, что излишки АФП просачиваются через пораженные участки, не покрытые кожей.
Хотя патогенез и неизвестен, остается фактом, что содержание АФП в амниотической жидкости при анэнцефалии повышено практически в 100% случаев, при манифестной форме spina bifida в 90%. Определение уровня АФП не позволяет исключить возможность ДЗНТ без кожного дефекта, хотя эта форма составляет 5—10% всех случаев.
С помощью данного теста можно диагностировать большое число патологических состояний. Проблема возникает при относительно доброкачественных заболеваниях, но особенно в тех случаях, когда плод здоров, а содержание АФП повышено.
Если у супружеской пары, обратившейся в генетическую консультацию, уже был ребенок с ДЗНТ, то степень повторного риска всегда более 1—2%. При повторной беременности может быть рекомендована пренатальная диагностика, в результате которой можно предотвратить рождение второго пораженного ребенка.
90% детей с ДЗНТ рождаются в семьях, где не было признаков, указывавших на генетическое предрасположение в семье. В настоящее время наиболее многообещающим кажется определение уровня АФП в сыворотке крови матери. После того как была установлена диагностическая ценность уровня АФП в амниотической жидкости, выяснилось, что при ДЗНТ уровень АФП повышен и в крови матери.
Уровень АФП в сыворотке крови матери может быть повышен не только при ДЗНТ, но и при ряде состояний, сопровождающихся высоким уровнем АФП. Если к этому добавить еще и не связанные с беременностью заболевания, которые могут сопровождаться повышением уровня АФП в сыворотке крови матери, то становится совершенно очевидным, что надо быть хорошо знакомым со всеми этими состояниями, чтобы сделать правильный вывод. Повышення концентрация АФП у матери может наблюдаться в следующих ситуациях:
· Аномалии развития плода: врожденный нефроз; врожденные дефекты кожи; омфалоцеле (exomphalos); расщепление желудка (gastroschisis); аномалия отпочкования конечностей с олигоамнионом, возможно, обусловленная просачиванием амниотической жидкости.
· Осложнения беременности: многоплодная беременность; замедленное развитие плода; угрожающий аборт; несостоявшийся выкидыш; внутриутробная гибель плода (в III триместре).
· Злокачественные заболевания матери: первичный рак печени; метастатические опухоли печени; тератокарциномы яичников; рак желудка и поджелудочной железы с метастазами в печень.
· Незлокачественные заболевания матери: острый хронический гепатит; неспецифический цирроз и жировое перерождение печени; врожденная тирозинемия; атаксия-телеангиэктазия. Если при повышенном уровне АФП в сыворотке крови матери возможно исключить аномалии развития плода, осложнения беременности и прочие заболевания матери, перечисленные выше, то в преобладающем большинстве случаев можно ожидать рождение здорового ребенка.
7.5. Предимплантационная генетическая диагностика
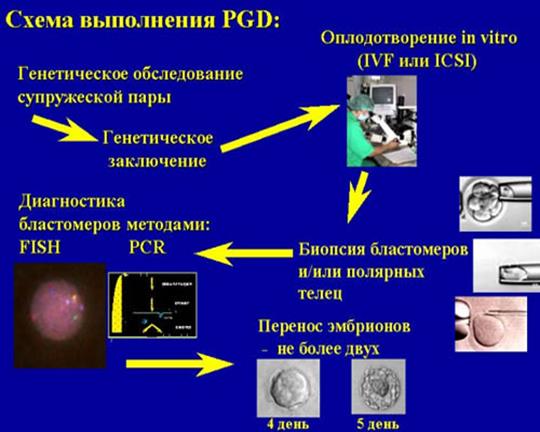
Предимплантационная генетическая диагностика (ПГД) проводится для диагностики наследственных заболеваний. Она была разработана в конце 1980-х годов как метод диагностики эмбриона на ранней стадии, призванный помочь супружеским парам, имеющим повышенный риск передачи наследственного заболевания своему ребенку. До появления предимплантационной генетической диагностики единственным вариантом для таких пар было проведение амниоцентеза.
Диагностика эмбриона проводится в цикле экстракорпорального оплодотворения (ЭКО) до его переноса в полость матки. После проведения анализа пациентке переносят только здоровые эмбрионы. Женщина беременеет, зная, что вынашиваемый ею ребенок не является носителем генетического заболевания.
ПГД может проводиться в ситуациях, когда имеется повышенный риск того, что эмбрионы будут иметь определенные хромосомные патологии. Такие патологии могут снизить вероятность имплантации (прикрепления) в матке, приводить к невынашиванию беременности или рождению ребенка с физическими или умственными отклонениями. ПГД помогает предотвратить такой неблагоприятный исход, поскольку позволяет отобрать здоровые эмбрионы до переноса в матку.
Не все генетические патологии могут быть диагностированы с помощью ПГД. Диагностика позволяет выявить отклонение в количестве хромосом (анеуплоидию) и изменения в структуре хромосом. Анеуплоидия чаще встречается в яйцеклетках и эмбрионах женщин старше 34 лет. Отсутствующие или лишние хромосомы могут приводить к выкидышу или рождению ребенка с физическими и психическими патологиями.
ПГД проводится для 9 хромосом, у которых чаще всего встречается анеуплоидия. Это хромосомы 13, 15, 16, 17, 18, 21, 22, X, Y. В настоящее время нельзя провести диагностику для всех 23 хромосом.
Изменения в структуре хромосом включают транслокации (структурные изменения хромосом), возникающие в результате перемещения генетического материала. Несбалансированная транслокация приводит к отсутствию части генетического материала и повышенному риску генетической патологии у потомства. Анализ на транслокации требует подготовки специальных красителей, позволяющих проверить наличие у эмбриона тех транслокаций, носителями которых являются родители. Предимплантационную диагностику транслокаций рекомендуется проводить в том случае, если известно, что один или оба супруга являются носителями определенной транслокации.
Другая патология, на которую можно провести предимплантационную диагностику - моногенное заболевание, связанное с изменениями в структуре отдельного гена. Если известно, что родители являются носителями моногенного заболевания, можно провести диагностику этого гена у эмбриона. Для проявления моногенного заболевания должны быть повреждены два гена, или один ген на X хромосоме, если ребенок – мальчик. Примерами таких заболеваний являются муковисцидоз, болезнь Тэй-Сакса, гемофилия, серповидноклеточная анемия. Сначала проводится диагностика родителей на носительство поврежденного гена, если у них в семье встречались случаи данного заболевания. Обследование родителей проводится перед началом цикла ЭКО и сопровождается медико-генетическим консультированием. Следует сказать, что проведение ПГД возможно не для всех болезней, имеющих генетическую причину, и, кроме того, не для всех наследственных заболеваний известен ген, определяющий проявление болезни.
Показания для проведения предимплантационной диагностики:
· Возраст женщины старше 34 лет
· Возраст мужчины старше 39 лет
· Носительство хромосомных перестроек, транслокаций, инверсий и других хромосомных и генетических патологий
· Привычное невынашивание беременности (более 2 выкидышей)
· Неудачные попытки ЭКО в анамнезе (более двух)
Преимущества предимплантационной диагностики:
· Выбор и перенос в матку только тех эмбрионов, которые не имеют хромосомных патологий
· Снижение риска рождения ребенка с определенными генетическими дефектами
· Снижение риска невынашивания (примерно в 2 раза)
· Снижение риска многоплодия (примерно в 2 раза)
· Увеличение шанса на успешную имплантацию (примерно на 10%)
· Увеличение шансов на благополучное рождение ребенка (примерно на 15-20%)
Риск при проведении предимплантационной диагностики:
· Риск случайного повреждения эмбриона (<1%)
· Ошибочная диагностика (до 10%)
· 3,5% вероятности того, что эмбрион с патологией будет диагностирован как нормальный
· 10% вероятности того, что здоровый эмбрион будет диагностирован как эмбрион с патологией
· Отмена переноса эмбрионов из-за того, что по результатам ПГД во всех эмбрионах будет обнаружена патология (до 20%)
ПГД проводится в ходе стандартного цикла экстракорпорального оплодотворения. При ПГД из эмбриона извлекают одну или две клетки, а затем проводят их генетический анализ методом FISH (fluorescent in situ hybridization) на анеуплоидии, транслокации и другие структурные патологии.
Другой тип диагностики - полимеразная цепная реакция (ПЦР), которая применяется для диагностики моногенных заболеваний. ПЦР проходит в два этапа:
1) биопсия эмбриона и фиксация бластомера;
2) генетическая диагностика.
Описание процедуры ПГД:
· Стандартная процедура ЭКО до этапа пункции яйцеклеток;
· Стандартные эмбриологические процедуры по обработке яйцеклеток, спермы, проведению микроманипуляций;
· Лабораторная процедура биопсии эмбриона на 3 день культивирования (с помощью механического, химического или лазерного метода), а затем фиксация бластомера;
· Генетическая диагностика зафиксированных бластомеров и получение результатов диагностики к 5 дню культивирования эмбрионов;
· Перенос в полость матки эмбрионов без генетических дефектов на 5 день культивирования на стадии бластоцисты;
· Стандартные процедуры криоконсервации после переноса эмбрионов;
· Стандартная процедура диагностики беременности примерно через две недели после переноса эмбрионов.
Как и в случае естественного зачатия, при проведении ЭКО не существует гарантии того, что не родится ребенок с невыявленными физическими или психическими отклонениями. Имеющиеся на сегодняшний день данные указывают на то, что риск развития патологий у детей после экстракорпорального оплодотворения (ЭКО) не выше такого риска после естественного зачатия.
Дата добавления: 2016-10-26; просмотров: 2035;











