Химические свойства карбоновых кислот
В карбоновых кислотах выделяют 4 реакционных центра:
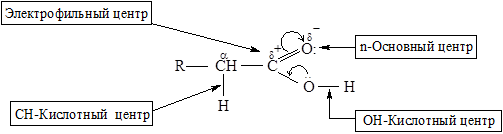
· ОН-кислотный центр, за счет которого карбоновые кислоты проявляют кислотные свойства в реакциях с основаниями;
· электрофильный центр – атом углерода карбоксильной группы, при участии которого карбоновые кислоты и их функциональные производные вступают в реакции нуклеофильного замещения;
· основный центр – оксогруппа со своей неподеленной парой электронов, которая протонируется на стадии катализа в реакциях нуклеофильного замещения;
· СН-кислотный центр, возникающий у α-атома углерода за счет индуктивного эффекта карбоксильной группы.
В карбоновых кислотах частичный положительный заряд на карбонильном атоме углерода меньше, чем в альдегидах и кетонах, поэтому кислота менее активна к восприятию атаки нуклеофильного реагента. Соответственно, реакции нуклеофильного присоединения более характерны для альдегидов и кетонов.
1. Реакции диссоциации (в «OH»-кислотном центре):
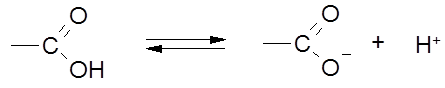 |
. Образование солей:
1) С активными металлами:
2 CH3COOH + Mg → (CH3COO)2Mg + H2
2) С основными оксидами:
2 CH3COOH + CaO → (CH3COO)2Ca + H2O
3) Со щелочами (реакция нейтрализации):
CH3COOH + NaOH → CH3COONa + H2O
4) С солями более слабых кислот:
CH3COOH + NaHCO3 → CH3COONa + CO2 ↑+ H2O
2 CH3COOH + Na2CO3 → 2 CH3COONa + CO2 ↑+ H2O
Эти реакции используются как качественные на карбоксильную группу (по выделению пузырьков CO2).
Образование солей дикарбоновыми кислотами:
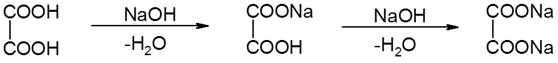

оксалат кальция
Около 80% почечных камней образуется из оксалата кальция.
Образование солей гидроксикислотами:

молочная кислота лактат кальция
Лактат кальция используется в медицине как кальциевый препарат.
1. Реакции галогенирования (реакции в СН-кислотном центре):
CH3 – CH2 – COOH + Br2 → CH3 – CH(Br) – COOH + HBr
α-бромпропионовая кислота
4. Реакции декарбоксилирования – реакции, в ходе которых происходит удаление углекислого газа из карбоксильной группы, приводящее к разрушению карбоксильной группы.
1) In vitro pеакции декарбоксилирования протекают при нагревании.
HOOC – COOH → HCOOH + CO2
щавелевая кислота муравьиная кислота
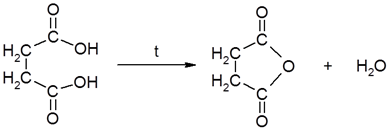
янтарная кислота ангидрид янтарной кислоты
2)In vivo реакции декарбоксилирования протекают с участием ферментов-декарбоксилаз (наибольшее значение имеют реакции декарбоксилирования гидрокси-, оксо-, аминокислот).
Пример: декарбоксилирование яблочной кислоты.
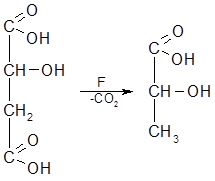 |
3) В организме также протекает окислительное декарбоксилирование, в частности, ПВК в митохондриях. С участием декарбоксилазы, дегидрогеназы и кофермента А (S-KoA). [ПВК= этаналь+ углекислый газ = ацетил-Ко-А+ НАДН+ Н+]
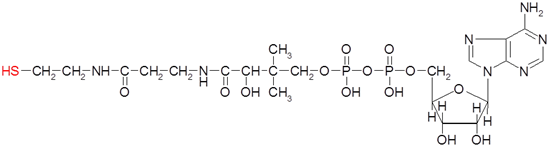
Ацетил-КоА, будучи активным соединением, вовлекается в цикл Кребса.
5. Реакции этерификации – нуклеофильного замещения (SN) у
sр2-гибридизованного атома углерода:
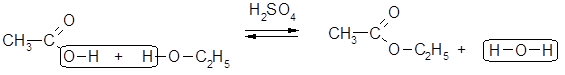 |
Реакции окисления
Окисление гидроксикислот протекает аналогично окислению вторичных спиртов с участием ферментов-дегидрогеназ.
1) Окисление молочной кислоты до пировиноградной кислоты:
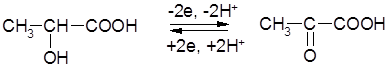 |
2) Окисление яблочной кислоты до щавелевоуксусной кислоты:
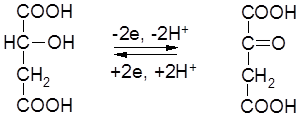 |
3) Окисление β-гидроксимасляной кислоты до ацетоуксусной кислоты:
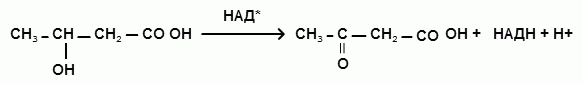
[β-гидроксимасляная кислота = ацетоуксусная кислота + НАДН + Н+]
Таким образом,при окислении гидроксикислот с участием ферментов-дегидрогеназ образуются кетонокислоты.
Пути превращения ацетоуксусной кислоты в организме:
В норме она подвергается гидролитическому расщеплению с участием
фермента гидролазы, при этом образуются 2 молекулы уксусной кислоты:
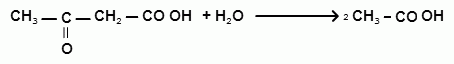
[ацетоуксусная кислота + вода = 2 уксусной кислоты]
При патологии ацетоуксусная кислота подвергается декарбоксилированию с образованием ацетона.
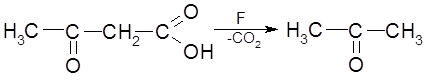 |
Кетоновые тела накапливаются в крови больных сахарным диабетом,
обнаруживаются в моче, они токсичны, особенно для нервной системы.
.
Дата добавления: 2016-10-18; просмотров: 8086;











