Экспериментальная часть
 Метод основан на измерении объёма водорода, который выделяется из кислоты при действии на неё металла. Объём водорода и масса металла пропорциональны их молярным массам эквивалентов.
Метод основан на измерении объёма водорода, который выделяется из кислоты при действии на неё металла. Объём водорода и масса металла пропорциональны их молярным массам эквивалентов.
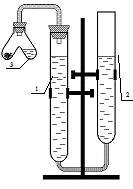
Применяемый для этой цели прибор – эвдиометр состоит из двух бюреток 1 (измерительная) и 2 (расширительная), заполненных частично водой. Бюретки укреплены на штативе, соединены резиновой трубкой и образуют два сообщающихся сосуда. Бюретка 1 закрыта пробкой с газоотводной трубкой, к которой присоединяется V-образная пробирка 3 (пробирка Оствальда).
Рис.2.1. Эвдиометр
Вначале необходимо определить цену деления измерительной бюретки. Цифры на бюретке обозначают объём в кубических сантиметрах. Показания бюретки снимаются по нижнему мениску жидкости, причем уровень жидкости и глаз наблюдателя должны быть на одной горизонтали.
Перед началом эксперимента необходимо проверить прибор на герметичность. Для этого присоедините пробирку Оствальда к измерительной бюретке и создайте разряжение, опуская расширительную бюретку на 10–20 см относительно измерительной бюретки. Если прибор герметичен, то уровень жидкости в измерительной бюретке немного опустится за счёт разряжения, а затем останется без изменений. В ином случае жидкость в бюретках 1 и 2 установится на одном уровне. Продолжать опыт на таком приборе нельзя; следует обратиться к преподавателю или инженеру.
Не присоединяя пробирку Оствальда, перемещайте расширительную бюретку и установите уровень жидкости в измерительной бюретке на нулевое деление или немного ниже.
Поместите в одно колено пробирки Оствальда навеску металла (занесите массу металла в табл. 2.1), а в другое колено налейте соляной кислоты от трети до половины объёма. Присоедините пробирку Оствальда к бюретке 1. Вновь проверьте прибор на герметичность. Приведите давление в измерительной бюретке к атмосферному. Для этого установите жидкость в бюретках на одном уровне, но не выше нулевого деления измерительной бюретки. Измерьте исходный объём газа в бюретке 1 (V1). Осторожно наклоняя пробирку Оствальда, прилейте кислоту к металлу. Произойдёт реакция с выделением водорода. По окончании реакции вновь приведите давление в измерительной бюретке к атмосферному, устанавливая жидкость в бюретках на одном уровне. Измерьте конечный объём газа в бюретке 1 (V2). Занесите объёмы V1 и V2 в табл. 2.1.
Использованную пробирку поместите в мойку. Эвдиометр приведите в исходное состояние.
Измерьте температуру в лаборатории и атмосферное давление. Результаты занесите в табл. 2.1.
Вычисления
1. Определите объем выделившегося водорода по формуле
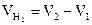 .
.
2. Определите парциальное давление водорода по
формуле
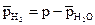 ,
,
где р – атмосферное давление; 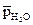 – парциальное давление паров воды при температуре опыта (см. прил. 2).
– парциальное давление паров воды при температуре опыта (см. прил. 2).
3. Найдите массу выделившегося водорода по уравнению Менделеева – Клапейрона:
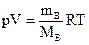 →
→ 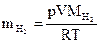 .
.
(Все величины для расчёта перевести в одну систему единиц!)
4. Найдите экспериментальную молярную массу эквивалента металла по уравнению закона эквивалентов
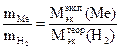 .
.
5. Найдите значение экспериментальной молярной массы металла по формуле
 .
.
6. Используя периодическую таблицу, определите зна-
чение истинной молярной массы металла и вычислите значение истинной молярной массы эквивалентов металла:
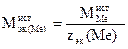
7. Вычислите относительную ошибку опыта по формуле
 .
.
8. Все экспериментальные и расчётные результаты сведите в табл.2.1..
Таблица 2.1. Экспериментальные и расчётные результаты
| № | Название величины | Обозначение | Единицы измерения | Численное значение | Единицы измерния в СИ | Числен-ное зна- чение в СИ |
| Масса металла | m | г | кг | |||
| Исходный объём | V1 | мл | м3 | |||
| Конечный объём | V2 | мл | м3 | |||
| Объём водорода | 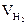
| мл | м3 | |||
| Температура | t | оС | К | |||
| Давление | p | мм Hg | Па | |||
| Парциальное давление пара воды | 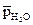
| мм Hg | Па | |||
| Парциальное давление водорода | 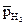
| мм Hg | Па | |||
| Масса водорода | 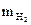
| г | кг | |||
| Экспериментальная молярная масса эквивалентов металла | 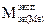
| г/моль | кг/моль | |||
| Истинная молярная масса эквивалентов металла | 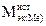
| г/моль | кг/моль | |||
| Относительная ошибка опыта | δ | % | % |
Выводы.Укажите возможные источники ошибки опыта.
Контрольные вопросы
1. Определите объём выделившегося водорода при
нормальных условиях по формуле объединённого газового закона
 ,
,
где верхний индекс (о) обозначает величину, соответствующую нормальным условиям.
2. Вычислите значение экспериментальной молярной массы эквивалентов металла, используя уравнение закона эквивалентов и молярный объём эквивалентов водорода. Сравните полученное значение молярной массы эквивалентов металла и ранее найденное.
Дата добавления: 2016-10-07; просмотров: 3174;











