Глава 2. Основные законы химии
Рабочая программа. Определение химии. Предмет химии.Законы сохранения массы, сохранения и превращения энергии. Закон постоянства состава. Закон эквивалентов. Эквивалент, число эквивалентности, фактор эквивалентности. Количество вещества эквивалентов. Молярная масса эквивалентов, молярный объём эквивалентов. Определение молярной массы эквивалентов простых веществ, бинарных соединений, гидроксидов, солей. Закон Авогадро. Количество вещества. Моль. Относительная молекулярная масса. Молярная масса. Атомно-молекулярная теория.
Химия относится к естественным наукам. Предметами изучения химии являются состав, свойства и структура веществ, законы превращений одних веществ в другие. Химия _ это наука о взаимных превращениях веществ.
Химия играет важнейшую роль в жизни человечества.
Производство химических удобрений, средств защиты растений и животных позволило решить проблему производства продуктов питания.
Создание и производство синтетических лекарственных препаратов позволило резко сократить смертность и увеличить среднюю продолжительность жизни человека.
Создание и производство искусственных и синтетических волокон и пленок решило проблему одежды и обуви.
Прогресс всех отраслей материального производства основан, прежде всего, на создании химической наукой материалов с особыми свойствами. Отсюда вытекает важность изучения химии для современного специалиста в любой области техники.
Закон сохранения массы. Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции.Открыт в 1748 г. М.В. Ломоносовым.
Закон сохранения и превращения энергии. Энергия не исчезает и не возникает вновь; ее различные формы могут переходить одна в другую в определенных, строго эквивалентных отношениях.
Между энергией и массой существует взаимосвязь, выражаемая формулой
 , (2.1)
, (2.1)
где ΔЕ – изменение энергии, Дж, соответствующее изменению массы Δm, кг; с – скорость света в вакууме, равная
2,99792. 108 м.с-1.
Из уравнения (2.1) следует, что любой химический процесс, сопровождающийся выделением или поглощением энергии, сопровождается соответственно уменьшением или увеличением массы. Тепловой эффект в 1 кДж соответствует изменению массы на 1,1.10-14 кг. Величина тепловых эффектов химических реакций редко превышает 103 кДж/моль. По этой причине изменением массы веществ в ходе химических реакций обычно пренебрегают как незначительным.
Закон постоянства состава. Любое химически чистое соединение имеет постоянные состав и свойства независимо от способа и места его получения.Закон был сформулирован французским химиком Ж. Прустом в начале XIX века. Позднее было установлено, что все химические вещества делятся на соединения постоянного состава (дальтониды) и соединения переменного состава (бертоллиды). К дальтонидам принадлежат большинство кислот, оснований, солей. К бертоллидам относятся многие двойные соединения, особенно соединения d-элементов. Например, в зависимости от способа получения моносульфид железа существует в интервале составов FeS0,8-1,14 , а оксиду титана (IV) соответствует формула TiO1,9-2,0. Закон постоянства состава применим только к соединениям постоянного состава.
Закон эквивалентов.Открыт И. Рихтером в период 1792–1802 гг. Вещества реагируют между собой в отношениях, пропорциональных молярным массам их эквивалентов.
В законе используется понятие эквивалент _ условные или реальные частицы вещества, в zB раз меньшие, чем соответствующие им формульные единицы.
Формульная единица вещества _ это реально существующие частицы, такие, как атомы (Н, С, О), молекулы ( N2, Н2О, HСl), ионы 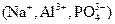 , или условно существующие частицы (NaCl, К2SO4) и т.д.
, или условно существующие частицы (NaCl, К2SO4) и т.д.
Число zB называют числом эквивалентности или эквивалентным числом.Это число принимает только целые, положительные значения;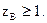 Значение zB определяют по химической реакции, в которой участвует данное вещество, или по формуле вещества. В зависимости от природы вещества и реакции, в которой это вещество участвует, число эквивалентности может быть переменным.
Значение zB определяют по химической реакции, в которой участвует данное вещество, или по формуле вещества. В зависимости от природы вещества и реакции, в которой это вещество участвует, число эквивалентности может быть переменным.
Величина, обратная числу эквивалентности, называется фактором эквивалентности; fB=1/zB.
Пример 2.1.Определить число эквивалентности: 1) серной кислоты в реакциях:
1а) H2SO4 + 2NaOH = Na2SO4 + 2H2O,
1в) H2SO4 + NaOH = NaHSO4 + H2O;
2) фосфора в реакциях:
2а) 4Р + 3О2 =2Р2О3;
2в) 4Р + 5О2 =2Р2О5.
Решение. 1) В обменной реакции нейтрализации (1а) 1 формульная единица (ФЕ) серной кислоты реагирует с 2 ФЕ гидроксида натрия, следовательно, число эквивалентности серной кислоты 
В реакции (1в) 1 ФЕ серной кислоты реагирует с 1 ФЕ гидроксида натрия, следовательно, число эквивалентности серной кислоты 
2) Взаимодействие фосфора с кислородом относится к окислительно-восстановительным реакциям. В этом случае число эквивалентности равно числу электронов, принимаемых 1ФЕ окислителя, или числу электронов, отдаваемых 1ФЕ восстановителя. В реакции (2а) фосфор выступает в роли восстановителя, и имеет место процесс
Р –3е = Р3+.
Следовательно, число эквивалентности фосфора zР=3.
В реакции (2а) имеем
Р –5е = Р5+ и zР=5.
Пример 2.2.Определить число эквивалентности соединения NH4 Fe(SO4)2 (железоаммонийные квасцы) в реакции
NH4 Fe(SO4)2 + 2СаСl2= 2CaSO4 ↓+ NH4 Сl + Fe Сl3.
Решение. В обменной реакции осаждения 1 формульная единица NH4 Fe(SO4)2 реагирует с 2 формульными единицами хлорида кальция. Число эквивалентности хлорида кальция равно двум, следовательно, 1 формульная единица NH4 Fe(SO4)2 реагирует с 4 эквивалентами хлорида кальция. Отсюда следует, что число эквивалентности NH4 Fe(SO4)2 равно четырём.
Число эквивалентности может быть формально определено по формуле вещества. Для простого вещества число эквивалентности равно абсолютной величине степени окисления, проявляемой одним атомом; для бинарных соединений – абсолютной величине суммы положительных или отрицательных степеней окисления атомов, составляющих соединение; для оснований, кислот и солей – абсолютной величине суммы положительных или отрицательных зарядов ионов, образующих соединение.
Пример 2.3.Определить числа эквивалентности:1) кислорода; 2) азота; 3) оксида азота (IV); 4) гидроксида кальция; 5) серной кислоты; 6) сульфата алюминия.
Решение. 1) Кислород проявляет степень окисления (-2), следовательно, число эквивалентности атомарного кислорода (О) zO=2, а число эквивалентности молекулярного кислорода (О2 ) 
2) Азот может иметь степени окисления (-3, -2, 0, +1, +2, +3, +4, +5). Следовательно, атомарный азот (N) может иметь числа эквивалентности 1, 2, 3, 4, 5, а молекулярный азот (N2), соответственно, 2, 4, 6, 8, 10.
3) Формула оксида азота (IV) – NO2. Степень окисления азота составляет (+4), а атома кислорода – (-2). Абсолютная величина суммы положительных или отрицательных степеней окисления составляет число эквивалентности 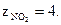
4 ) Гидроксид кальция Са(ОН)2 диссоциирует по урав-
нению

Абсолютная величина суммы зарядов положительного иона кальция (катиона) или двух отрицательных ионов гидроксида (анионов) равна 2. Следовательно, 
5) Серная кислота диссоциирует по уравнению

Абсолютная величина суммы зарядов двух положительных ионов водорода или отрицательного иона (сульфат-иона) равна 2. Следовательно, 
6) Сульфат алюминия Al2(SO4)3 диссоциирует по уравне
нию
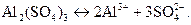
Абсолютная величина суммы зарядов двух положительных ионов алюминия или трех отрицательных ионов (сульфат-ионов) равна 6. Следовательно, 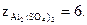
Подчеркнем, что определение числа эквивалентности по формуле носит формальный характер, т.к. не связано с конкретной химической реакцией.
Применение закона эквивалентов требует введения понятия количества вещества эквивалентов В(символ nэк(В), единица – моль) – физической величины, пропорциональной числу эквивалентов вещества В, Nэк(В):
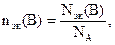 (2.2)
(2.2)
где NA – постоянная Авогадро.
Например: nэк(3;Н3РO4)= 1,5 моль, nэк(2;Са2+)= 2 ммоль. Цифры 3 и 2 – значения чисел эквивалентности.
Так как в одной формульной единице вещества В содержится zB эквивалентов этого вещества, то справедливо соотношение
nэк(В)=zВnB , (2.3)
где nB – количество вещества В, моль.
В расчетах на основе закона эквивалентов используется также понятие молярной массы эквивалентов вещества В (символ Мэк(В),единица _ кг/мольили г/моль) – это отношение массы вещества В (mB) к количеству вещества эквивалентов В (nэк(В)):
 (2.4)
(2.4)
Молярная масса эквивалентов вещества В всегда в zB раз меньше молярной массы этого же вещества. Поэтому для вычислений можно использовать также следующую формулу:
 (2.5)
(2.5)
Для газообразных веществ используют также понятие молярного объема эквивалентов вещества В (символ Vэк(В),единица _ л/мольили дм3/моль). Эта величина может быть найдена как отношение молярного объема вещества В (VB) к числу эквивалентности вещества В (zэк(В)):
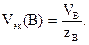 (2.6)
(2.6)
Для реакции вещества А с веществом В закон эквивалентов может быть записан следужщим образом:
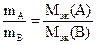 . (2.7)
. (2.7)
Если в реакцию вступают газообразные вещества, то массы и молярные массы эквивалентов в формуле (2.7) могут быть заменены на объёмы и молярные объёмы эквивалентов, разумеется, приведённые к одинаковым условиям.
Пример 2.4.Определить молярную массу эквивалентов следующих веществ: 1) Cr2O3; 2) фосфора в соединении РН3; 3) соли NaH2PO4 в реакции NaH2PO4 + 2NaOH = Na3PO4 + 2 H2O.
Решение. 1) Степень окисления атома кислорода в оксиде (Cr2O3) составляет (-2). Абсолютная величина суммы степеней окисления трех атомов кислорода – 6. Следовательно, число эквивалентности оксида равно 6. Молярная масса Cr2O3
 г/моль.
г/моль.
Таким образом, молярная масса эквивалентов Cr2O3
 г/моль.
г/моль.
2) Степень окисления атома водорода в гидриде фосфора (фосфин) РН3 составляет (+1). Абсолютная величина суммы степеней окисления трех атомов водорода составляет 3. Следовательно, степень окисления фосфора равна (-3) и число эквивалентности фосфора равно 3. Молярная масса фосфора составляет 31 г/моль, а молярная масса эквивалентов фосфора в фосфине
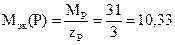 г/моль.
г/моль.
3) Одна формульная единица дигидрофосфата натрия (NaH2PO4) реагирует с двумя формульными единицами гидроксида натрия. Число эквивалентности гидроксида натрия равно 1, следовательно, число эквивалентности NaH2PO4 в данной реакции составляет 2. Таким образом, молярная масса эквивалентов NaH2PO4 будет
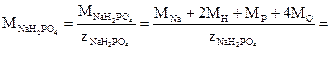
=(23+2.1+31+4.16)/2=60 г/моль.
Пример 2.5.Сульфид металла содержит 67,15% металла. Вычислить молярную массу эквивалентов металла, если молярная масса эквивалентов серы составляет 16 г/моль.
Решение. Из условия задачи следует, что 100 г сульфида металла содержит 67,15 г металла и 32,85 г серы. Согласно закону эквивалентов эти массы пропорциональны молярным массам эквивалентов металла и серы. Следовательно,
67,15 г металла эквивалентны 32,85 г серы,
Мэк(Ме) эквивалентна Мэк(S)=16 г/моль серы.
Откуда
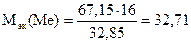 г/моль.
г/моль.
Пример 2.6.На восстановление 1 г оксида металла израсходован 421 см3 водорода (н.у.). Вычислить молярные массы эквивалентов оксида и металла.
Решение. Число эквивалентности молекулярного водорода Н2 равно двум, следовательно, молярная масса эквивалентов водорода
 г/моль.
г/моль.
В соответствии с законом Авогадро объем 1 моль водорода при н.у. составляет 22,4 л, следовательно, молярный объем эквивалентов водорода при н.у.
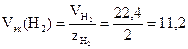 л/моль = 11200 см3/моль.
л/моль = 11200 см3/моль.
В соответствии с законом эквивалентов масса оксида и объем водорода, вступившие в реакцию, пропорциональны молярным массам (молярным объемам) их эквивалентов. Значит,
1 г оксида эквивалентен 421 см3 водорода,
Мэк(оксид) эквивалентна 11200 см3/моль водорода.
Откуда
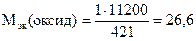 г/моль.
г/моль.
Любой оксид состоит из кислорода и другого элемента, соединенных в эквивалентных количествах. Следовательно, молярная масса эквивалента оксида равна сумме молярных масс эквивалентов кислорода и металла, образующего оксид:
Мэк(оксид)=Мэк( металл) + Мэк(О).
Число эквивалентности кислорода zO=2, значит,
 г/моль.
г/моль.
Таким образом, молярная масса эквивалентов металла, образующего оксид, составляет
Мэк( металл)= Мэк(оксид) - Мэк(О)= 26,6 – 8 =18,6 г/моль.
Пример 2.7.В реакцию с 10,0 г едкого натра вступило 22,25 г пирофосфорной кислоты (Н4Р2О7). Найти молярную массу эквивалента, число эквивалентности и основность кислоты в этой реакции.Записатьуравнение реакции.
Решение. В соответствии с законом эквивалентов массы гидроксида натрия и пирофосфорной кислоты, вступившие в реакцию, эквивалентны. Число эквивалентности гидроксида натрия постоянно и равно единице. Следовательно, молярная масса эквивалента гидроксида натрия равна его молярной массе:
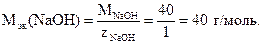
На основании закона эквивалентов запишем:
22, 25 г Н4Р2О7 реагируют с 10 г NaOH,
Mэк(Н4Р2О7) - “ - 40 г NaOH,
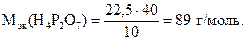
Находим число эквивалентности пирофосфорной кислоты в данной реакции:
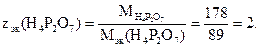
Число эквивалентности кислоты в реакции нейтрализации соответствует числу ионов водорода, замещённых катионами металла, т.е. основности кислоты. Следовательно, основность пирофосфорной кислоты в данном случае равна двум и уравнение реакции имеет вид
Н4Р2О7 + 2 NaOH = Na2Н2Р2О7 + 2H2O.
Закон Авогадро.Открыт в 1811 г. итальянским физиком А. Авогадро. В равных объемах различных газов при одинаковых давлении и температуре содержится одинаковое число молекул.
При нормальных условиях (температура 0 оС=273,15 К и давление 1 атм =760 мм рт.ст.= 101325 Па=101,325 кПа) один моль любого газа содержит 6,022045•1023  6,02•1023 молекул (постоянная Авогадро) и занимает объем 22 414 см3
6,02•1023 молекул (постоянная Авогадро) и занимает объем 22 414 см3  22,4 дм3 .
22,4 дм3 .
Закон Авогадро позволяет определить молярную массу газа, если известна его плотность (ρ) при нормальных условиях:
МВ=22,4 ρ, (2.8)
или плотность при нормальных условиях, если известна молярная масса. Можно также определить молярную массу неизвестного газа (Мх), зная молярную массу известного газа (МВ) и отношение плотностей этих газов (ρх/ρВ):
 (2.9)
(2.9)
Отношение ρх/ρВ носит название относительной плотности одного газа по другому и обозначается буквой D. Например, если использовать относительную плотность неизвестного газа по водороду и воздуху, то формула (2.8) запишется следующим образом:
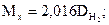 (2.9а)
(2.9а)

 (2.9б)
(2.9б)
Если условия, при которых находится газ, не сильно отличаются от нормальных, то для определения молярной массы газа используют уравнение состояния идеальных газов Менделеева – Клапейрона.
Пример 2.8.Какой объем занимает 1 г углекислого газа при н.у.?
Решение. Молярная масса углекислого газа СО2 составляет 44 г/моль. Из закона Авогадро следует, что при нормальных условиях
44 г углекислого газа занимают объем 22,4 л,
1 г углекислого газа занимает объем Vo л.
Следовательно,
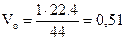 л.
л.
Пример 2.9.Относительнаяплотность газа по водороду составляет 6. Какой объем будут занимать 2 г этого газа при н.у.?
Решение. Определим молярную массу газа по уравнению (2.9а):
М = 2,016.6= 12,096 г/моль.
В соответствии с законом Авогадро
12,096 г газа занимают объем 22,4 л,
2 г газа занимают объем Vо л.
Откуда
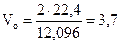 л.
л.
Пример 2.10.8,8 г вещества при температуре 22 °С и давлении 500 мм рт.ст. заняло объём 3,68 дм3. Какова молярная масса этого вещества?
Решение. Применим формулу Менделеева –Клапейрона (1.2):
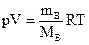 .
.
Все величины, входящие в формулу, должны быть выражены в одной системе единиц. Используем международную систему единиц СИ: кг, Па, м3, R=8,31 Дж/(моль•К).
В этом случае масса вещества составит 8,8•10-3 кг; температура 273+22=295 К; давление (500/760).101325= =66661 Па; объём 3,68•10-3 м3. Выразим молярную массу из уравнения Менделеева – Клапейрона:

Можно также воспользоваться значением R=62,36 (л•мм рт. ст.)/(моль•К). Тогда
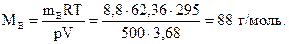
Рассмотренные в этом разделе законы, а также некоторые другие легли в основу атомно-молекулярной теории – основу современной химии.
Атомно-молекулярная теория.Основные положения теории были сформулированы Д. Дальтоном в начале XIX в. Они заключаются в следующем.
1. Каждый элемент состоит из мельчайших частиц, называемых атомами.
2. Все атомы одного элемента одинаковы.
3. Атомы разных элементов обладают разными свойствами.
4. Атомы не создаются и не разрушаются в химических реакциях.
5. В результате комбинации атомов двух или нескольких элементов образуются молекулы.
6. В данном соединении относительные количества атомов разных сортов и сорта этих атомов всегда постоянны.
Для характеристики атомов и молекул используют понятия относительной атомной массы (Аr), относительной молекулярной массы (Mr) и молярной массы вещества (МВ)(см. гл. 1 (Вводный курс)).
Масса атома любого элемента (абсолютная атомная масса атома) равна произведению его относительной атомной массы и атомной единицы массы (а.е.м.):
mэ = Ar. (а.е.м.),
1 а.е.м. = 1,6606•10-27кг.
Пример 2.11.Найти массу атома кислорода (абсолютную массу атома кислорода).
Решение. Масса атома кислорода составляет
Ао = 16 • 1,66•10-27 = 2,656•10-26кг = 2,656•10-23г.
Вопросы и задачи для самостоятельной подготовки
1. Сформулируйте закон сохранения массы и границы применимости этого закона.
2. Сформулируйте закон постоянства состава и область применения этого закона.
3. Сформулируйте закон эквивалентов. К каким реакциям применим этот закон?
4. Сформулируйте понятия: эквивалент, число эквивалентности, фактор эквивалентности.
5. Сформулируйте понятия:количество вещества эквивалентов, молярная масса эквивалентов, молярный объем эквивалентов.
6.Определите числа эквивалентности:1) атомарного и молекулярного фтора; 2) магния; 3) оксида серы (IV); 4) гидроксида калия; 5) угольной кислоты; 6) нитрата кальция.
Ответ: 1)1, 2; 2)2; 3)4; 4) 1; 5) 2; 6)2.
7.Определите молярную массу эквивалентов следующих веществ: 1)V2O5; 2) серы в соединении Н2S; 3) соли Na2HPO4 в реакции Na2HPO4 + HCl = NaH2PO4 + NaCl.
Ответ: 1)18,2; 2)16; 3)142.
8.Хлорид металла содержит 25,8 % металла. Вычислите молярную массу эквивалентов металла, если молярная масса эквивалентов хлора составляет 35,5 г/моль.
Ответ:12,3 г/моль.
9.Для реакции с 2 г металла потребовалось 1,12 дм3 хлора (н.у.). Вычислите молярные массы эквивалентов металла и его оксида.
Ответ:20; 28 г/моль.
10. Сформулируйте закон Авогадро.
11.Какой объем занимает 1,7 г аммиака при н.у.?
Ответ:1,12 л.
12. Определите относительную плотность кислорода по гелию.
Ответ: 8.
13.Относительнаяплотность газа по азоту составляет 5,214. Вычислите молярную массу газа и объём 2,92 г этого газа при н.у.?
Ответ:146 г/моль; 0,448 л.
14.Найдите массу одной формульной единицы едкого натра.
Ответ:6,64•10-26кг.
2.2. Задания для текущих и промежуточных контролей
Раздел I
1. Какое количество вещества и сколько молекул при нормальных условиях содержится в 2,8 л газа?
Ответ: 0,125 моль; 7,5•1022 молекул.
2. Сколько молекул и какое количество вещества содержится в 15 г оксида азота (II)?
Ответ: 3,01•1023 молекул; 0,5 моль.
3. Молекула некоторого вещества имеет массу, равную 1,2•10-25 кг. Найдите относительную молекулярную массу вещества.
Ответ: 72,3.
4. Масса 2 л газа (н.у.) равна 2,35 г. Вычислите относительную молекулярную массу газа и массу одной молекулы газа.
Ответ: 26,3; 4,4•10-23 г.
5. В какой массе диоксида серы (SO2) содержится столько же молекул, сколько их содержится в 2,5 л SO2 (н.у.)?
Ответ: 7,14 г.
6. Вычислите массу 0,25 моль кислорода. Какой объем (н.у.) занимает это количество вещества? Сколько молекул кислорода содержится в этом объеме?
Ответ: 8 г; 5,6 л; 1,5•1023 молекул.
7. Определите, какое количество вещества и сколько формульных единиц вещества (молекул) содержится в 552 г карбоната калия.
Ответ: 4 моль; 2,4•1024 молекул.
8. Какое количество вещества и сколько молекул содержится в 128 г оксида серы (IV)? Какой объем (н.у.) занимает это число молекул?
Ответ: 2 моль; 1,2•1024 молекул; 44,8 дм3.
9. Рассчитайте молярную массу газа, если масса 1 мл его равна 1,96 мг (н.у.).
Ответ: 43,9 г/моль.
10. Рассчитайте массу 10 л азота при нормальных условиях.
Ответ: 12,5 г.
11. Пары 0,0240 кг вещества при температуре 27 °С и давлении 912 мм рт.ст. занимают пространство объёмом 0,0250 м3. Какова молярная масса этого вещества?
Ответ: 0,0197 кг/моль.
12. В ёмкости вместимостью 1500 м3 при температуре –25 °С и давлении 4,00 атм содержится этилен. Определите его массу. Каким станет давление газа в ёмкости, если температура повысится до 25 °С?
Ответ: 8260 кг; 4,81 атм.
13. 2,00•10–4 кг вещества, испарившись при температуре 22 °С и давлении 405 мм рт.ст., заняло объём 9,5•10-5 м3. Какова молярная масса этого вещества?
Ответ: 0,0956 кг/моль.
14. Какую массу будет иметь водород, занимающий при нормальных условиях объём 280 л?
Ответ: 25 г.
15. Сколько литров оксида углерода (IV) выделится при действии хлороводородной кислоты на 25 г карбоната кальция при нормальных условиях?
Ответ: 5,6 л.
16. Какой объем кислорода необходим для сгорания 3,36 л этилена (н.у.)?
Ответ: 10,08 л.
17. Определите молярную массу газа, если 1,56 л газа при температуре 27 °С и давлении 1,037.105 Па имеет массу 2,86 г.
Ответ: 44 г/моль.
18. Относительная плотность газа по воздуху равна 0,9. Определите массу 1 л газа.
Ответ: 1,165 г.
19. Из скольких атомов состоят молекулы: а) паров серы при температуре 950 °С, если относительная плотность их по воздуху равна 2,2; б) паров сурьмы при температуре 2000 °С, если относительная плотность их по водороду равна 60,88?
Ответ: 2; 1.
20. Какую массу карбоната кальция необходимо взять, чтобы полученным при его разложении оксидом углерода (IV) наполнить баллон вместимостью 40 л при температуре 15 °С и давлении 1,013•106 Па?
Ответ: 1,693 кг.
21. Вычислите относительную плотность по воздуху газа пропана (С3Н8), если его относительная плотность по водороду равна 22.
Ответ: 1,517.
22. Какова масса 1 л газа, измеренного при нормальных условиях, если его молярная масса равна 71 г/моль?
Ответ: 3,17 г.
23. Некоторый газ массой 5,6 г занимает объем 4,84 л при температуре 17 °С и давлении 0,997•105 Па. Чему равна относительная молекулярная масса этого газа?
Ответ: 28 г/моль.
24. Чему равна относительная молекулярная масса органического вещества, если оно массой 1,3 г в парообразном состоянии занимает объём 0,6 л при температуре 87 °С и давлении 8,3•104 Па?
Ответ: 78 г/моль.
25. Какой объём занимают 3,01•1023 молекулы углекислого газа при нормальных условиях?
Ответ: 11,2 дм3.
26. Во сколько раз отличается число молекул, содержащихся в 20 г водорода и 20 г кислорода?
Ответ: в 16 раз.
27. Какой объём занимают 11 г углекислого газа при температуре 27 °С и давлении 3 атм?
Ответ: 2,05•10-3 м3.
28. Какой объём занимают 50 г оксида серы (IV) при давлении 380 мм рт.ст. и температуре 47 °С?
Ответ: 0,041 м3.
29. Какое количество сульфида железа (FeS) необходимо взять, чтобы получить 100 л сероводорода при нормальных условиях?
Ответ: 392,86 г.
30. Каково давление в сосуде вместимостью 22,4 л, содержащем 16 г оксида серы (IV), при температуре 0 °С?
Ответ: 25,3 кПа.
Раздел II
Определите число эквивалентности и вычислите значения молярных масс эквивалентов указанных веществ в следующих реакциях:
1. HNO3 + Bi(OH)3 = Bi(OH)2NO3 + H2O.
2.H2S + NaOH = NaHS + H2O.
3.3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O.
4. 2HCl + Bi(OH)3 = BiOHCl2 + 2H2O.
5. 3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2 + 6H2O.
6.H3PO4+ Ca(OH)2 = CaHPO4 + 2H2O.
7. H2SO4+ KOH = KHSO4 + H2O.
8. H2SO4 + Mg = MgSO4 + H2.
9. Al(OH)3 + HCl = Al(OH)2Cl + H2O.
10. Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O.
11. 2H3PO4+ Ca(OH)2 = Ca(H2PO4)2 + 2H2O.
12. H2CO3 + 2NaOH = Na2CO3 + H2O.
13.Fe(OH)2CH3COO + 3HNO3 = Fe(NO3)3 + CH3COOH + 2H2O.
14. Fe(OH)2NO3 + HNO3 = FeOH(NO3)2 + H2O.
15. CaCO3 + 2HCl = CaCl2 + H2O + CO2.
16. NaHCO3 + HCl = NaCl + H2O + CO2.
17. Cu(OH)2 + 2HCl = CuCl2 + 2H2O.
18. Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2.
19. KCr(SO4)2 + 3KOH = Cr(OH)3 + 2K2SO4.
20. KCr(SO4)2 + 2Ba(NO3)2 = 2BaSO4 + KNO3 + Cr(NO3)3.
21. Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4.
22. KAl(SO4)2 + 2BaCl2 = KCl + AlCl3 + 2BaSO4.
23. KAl(SO4)2+ 3KOH = Al(OH)3 + 2K2SO4.
24. H3AsO4+ 2NaOH = Na2HAsO4 + 2H2O.
25. CaHPO4 + H3PO4 = Ca(H2PO4)2.
26. CuOHCl+ H2S = CuS + HCl + H2O.
27. H3PO4 + Ca(OH)2 = CaHPO4 + 2H2O.
28. NaHSO4+ NaOH = Na2SO4 + H2O.
29. 3CaHPO4 + 3NaOH = Na3PO4 + Ca3(PO4)2 + 3H2O.
30. Fe(OH)2Cl + NaOH = Fe(OH)3 + NaCl.
Раздел III
1. Вычислите молярную массу эквивалентов, число эквивалентности и кислотность гидроксида алюминия, зная, что 1,95 г его прореагировало с 3,15 г азотной кислоты. Составьте уравнение реакции.
Ответ: 39 г/моль; 2; 2.
2. Определите молярную массу эквивалентов металла, зная, что для полного растворения 8,16 г этого металла потребовалось 20 г серной кислоты  .
.
Ответ: 20 г/моль.
3. На нейтрализацию 0,944 г фосфористой кислоты (H3PO3) израсходовано 1,289 г гидроксида калия. Вычислите молярную массу эквивалентов, число эквивалентности и основность кислоты. Составьте уравнение реакции.
Ответ: 41 г/моль; 2; 2.
4. Определите массу оксида двухвалентного металла, которая пошла на реакцию с 5,6 л водорода (н.у.), если молярная масса эквивалентов оксида металла 39,77 г/моль.
Ответ: 19,89 г.
5. Число эквивалентности серной кислоты в реакции с гидроксидом натрия равно 2. Какая масса гидроксида потребуется для реакции с 19,6 г кислоты.
Ответ: 16 г.
6. 4,285 г металла вытесняют из кислоты 4 л водорода (н.у.). Вычислите молярную массу эквивалентов металла.
Ответ:12 г/моль.
7. На нейтрализацию 3,655 г фосфорноватистой кислоты (H3PO2) израсходовано 2,215 г гидроксида натрия. Вычислите молярную массу эквивалентов и основность кислоты. Составьте уравнение реакции.
Ответ: 66 г/моль; 1.
8. При взаимодействии с кислотой 0,0895 г металла выделилось 119 мл водорода, измеренного при температуре 18 оС и давлении 101 кПа. Вычислите молярную массу эквивалентов металла.
Ответ: 9 г/моль.
9. Найдите молярную массу эквивалентов двух металлов по следующим экспериментальным данным: навеска первого металла массой 2,0000 г и навеска второго массой 1,0582 г образуют оксиды массой, соответственно равной 2,5036 и 2,0000 г.
Ответ: 31,8 г/моль; 9 г/моль.
10. При растворении в кислоте 11,9 г металла выделилось 2,24 л водорода (н.у.). Чему равна молярная масса эквивалентов металла?
Ответ: 59,5 г/моль.
11. Для растворения 16,86 г металла потребовалось 14,7 г серной кислоты. Вычислите молярную массу эквивалентов металла  .
.
Ответ: 56,2 г/моль.
12. На восстановление 1,8 г оксида металла израсходовано 883 мл водорода (н.у.). Найдите молярную массу эквивалентов этого металла.
Ответ: 14,8 г/моль.
13. Чему равна молярная масса эквивалентов металла, если его навеска массой 20 г вытесняет из кислоты водород объемом 7,5 л при температуре 18 °С и давлении 1,013•105 Па?
Ответ: 31,8 г/моль.
14. К раствору, содержащему 1 г соляной кислоты, прибавили раствор, содержащий 1 г гидроксида натрия. Будет ли полученный раствор нейтральным, кислым или щелочным? Ответ подтвердите расчетом.
Ответ: nэк(HCl) = 0,027 моль> nэк(NaOH) = 0,025 моль; раствор кислый.
15. Металл массой 0,50 г вытеснил из раствора кислоты 198 мл водорода при температуре 25 °С и давлении 721,2 мм рт.ст. Рассчитайте молярную массу эквивалентов металла.
Ответ: 32,5 г/моль.
16. При взаимодействии 6,75 г металла с серой образовалось 18,75 г сульфида. Рассчитайте молярную массу эквивалентов металла.
Ответ: 9 г/моль.
17. Металл массой 2,000 г вытесняет 1,132 г меди из раствора ее соли. Массовая доля кислорода в оксиде меди составляет 20 %. Определите молярную массу эквивалентов этого металла.
Ответ: 56,5 г/моль.
18. Массовые доли галогена в галогениде металла и кислорода в его оксиде соответственно равны 64,5 и 15,4 %. Определите молярную массу эквивалентов галогена и назовите его.
Ответ: 80 г/моль; бром.
19. Йод массой 0,7280 г взаимодействует с 0,5935 г металла. Определите молярную массу эквивалентов этого металла.
Ответ: 103,5 г/моль.
20. Определите молярную массу эквивалентов металла, если 0,046 г его вытеснили из кислоты 62,35 мл водорода, измеренного при температуре 17 °С и давлении 0,9977•105 Па.
Ответ: 8,9 г/моль.
21. Определите молярную массу эквивалентов металла, если 0,0350 г этого металла, содержащего 20 % не взаимодействующих с кислотой примесей, выделяют из кислоты 11,9 мл водорода, измеренного при температуре 17 °С и давлении 1,0107•105 Па.
Ответ: 28,1 г/моль.
22. Сколько оксида получится при окислении 3 г металла, молярная масса эквивалентов которого равна 9 г/моль?
Ответ: 5,67 г.
23. Сколько оксида получится при окислении 3 г металла, молярная масса эквивалентов которого равна 12 г/моль?
Ответ: 5 г.
24. При взаимодействии 1,28 г металла с водой выделилось 380 мл водорода, измеренного при температуре 21 °С и парциальном давлении водорода 102,01 кПа. Определите молярную массу эквивалентов металла.
Ответ: 40,3 г/моль.
25. 1,00 г некоторого металла соединяется с 8,88 г брома или с 1,78 г серы. Определите молярные массы эквивалентов брома и металла.
Ответ: 79,9 г/моль; 9 г/моль.
26. Определите молярные массы эквивалентов металла и серы, если 3,24 г металла образуют 3,48 г оксида или 3,72 г сульфида.
Ответ: 108 г/моль; 16 г/моль.
27. Вычислите молярную массу эквивалентов металла, зная, что его хлорид содержит 79,78 % хлора. Молярная масса эквивалентов хлора равна 35,45 г/моль.
Ответ: 9 г/моль.
28. Мышьяк (As) образует два оксида, содержащих 65,2 и 75,7 % As. Рассчитайте молярную массу эквивалентов мышьяка в этих оксидах.
Ответ: 15 г/моль; 25 г/моль.
29. В 4,96 г оксида одновалентного металла содержится 3,68 г металла. Вычислите молярные массы эквивалентов металла и его оксида.
Ответ: 23 г/моль; 31 г/моль.
30. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалентов металла и его оксида и молярную массу металла.
Ответ: 27,9 г/моль; 35,9 г/моль; 55,8 г/моль.
Дата добавления: 2016-10-07; просмотров: 6429;











