Способы выражения концентраций растворов
Концентрация вещества – физическая величина (размерная или безразмерная), определяющая количественный состав раствора или смеси. Ниже будет рассмотрен один способ выражения концентрации растворов – массовая доля.
Массовая доля растворенного вещества В (символ ωВ, безразмерная величина) равна отношению массы растворенного вещества В (mB) к массе раствора (mp):
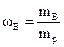 .(1.3)
.(1.3)
Умножая массовую долю на 100, получают массовый процент растворенного вещества В, называемый часто процентной концентрацией, хотя термин «процентная концентрация» не рекомендован к использованию.
Масса раствора и объем связаны между собой соотношением
m = ρ∙V, (1.4)
где m – масса раствора; V – объём раствора; ρ – плотность раствора.
Отметим, что для приближенных расчётов плотность воды при температурах, не сильно отличающихся от 25 оС, принимают равной 1 г/см3.
Пример 1.13.Найти массы хлорида натрия и воды, содержащиеся в 30 г раствора поваренной соли с массовой долей 0,06.
Решение. Массовая доля 0,06 означает, что в 100 г раствора содержится 6 г NaCl. Следовательно,
в 100 г раствора содержится 6 г NaCl,
а в 300 г - “ - - “ - х г - “ - ,
 .
.
Масса раствора равна сумме масс растворителя и растворенного вещества, следовательно, масса растворителя равна разности масс раствора и растворенного вещества:
300 - 18 = 282 г H2O.
Пример 1.14.Какой объем воды потребуется для приготовления раствора сульфата натрия с массовой долей 0,01 из 15 г соли?
Решение. Массовая доля соли, равная 0,01, означает, что в 100 г раствора содержится 1 г растворенного вещества:
1 г Na2SO4 содержится в 100 г раствора,
15 г - “ - - “ - - “ - х г - “ - ,
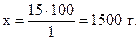
Масса раствора равна сумме масс растворителя и растворенного вещества, следовательно, масса растворителя равна разности масс раствора и растворенного вещества:
1500 -15 = 1485 г.
Плотность воды принимаем ρ=1 г/см3, и, следовательно, объем воды численно равен её массе и составляет 1485 см3.
Пример 1.15.Найти массы кристаллогидрата пентагидрата сульфата меди (медный купорос, CuSO4.5Н2О) и воды, необходимые для приготовления 400 г 5% раствора.
Решение. Концентрация 5% означает, что в 100 г раствора содержится 5 г безводной соли, т.е. сульфата меди CuSO4 (концентрация раствора всегда выражает содержание безводной соли). Следовательно, источником части воды, входящей в состав раствора, будет кристаллогидрат CuSO4.5Н2О.
Найдем массу безводной соли, используя пропорцию:
100 г раствора содержат 5 г CuSO4,
400 г - “ - - “ - x г - “ - ,
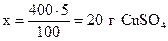 .
.
Найдём массу кристаллогидрата, соответствующую 20 г безводной соли, исходя из молярных масс CuSO4.5Н2О (М=250 г/моль) и CuSO4 (М=160 г/моль):
160 г CuSO4 содержатся в 250 г CuSO4.5Н2О,
20 г - “ - - “ - x г - “ - ,
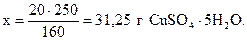
Следовательно, для приготовления 400 г 5% раствора CuSO4 необходимо взять 31,25 г CuSO4.5Н2О и 400 – 31,25 = 368,75 г воды. При этом в 400 г раствора будет содержаться 20 г CuSO4 и 380 г воды.
Пример 1.16.Найти массовую долю хлороводорода в растворе, полученном смешением 100 мл 5% (ρ=1,023 г/см3) и 200 мл 20% (ρ=1,098 г/см3) соляной кислоты.
Решение. Найдём массы исходных растворов:
m5%=100.1,023=102,3 г; m10%=200.1,098=219,6 г.
Масса раствора после смешения состави
m=102,3+219,6=321,9 г .
Найдём массы HCl, содержащиеся в исходных растворах, по формуле
mHCl=mр-р.ω.
m=102,3.0,05=5,115 г;
m=219,6.0,20=43,92 г.
Масса хлороводорода в растворе после смешения составит
m= 5,115 + 43,92 = 49,035 г,
а массовая доля HCl –

Пример 1.17.В результате упаривания 500 г 2% раствора сульфата натрия получено 300 г раствора. Найти массовую долю растворённого вещества в полученном растворе.
Решение. В процессе упаривания из раствора улетучивалась вода, т.к. сульфат натрия практически не летуч. Следовательно, масса растворённого вещества не изменилась и составляет
500•0,02=10 г Na2SO4.
Массовая доля сульфата натрия в растворе после упаривания
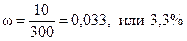 .
.
Пример 1.18.Какие объёмы 98% серной кислоты (ρ=1,8365 г/см3) и воды потребуются для приготовления 1 л 5% раствора (ρ=1,0315 г/см3)?
Решение. Найдём массу 1 л 5% раствора:
m=1000•1,0315=1031, 5 г.
Масса серной кислоты в 5% растворе составит
m=1031,5•0,05=51,55 г.
Найдём массу 98% раствора, в которой содержится 51,55 г серной кислоты:
100 г 98% раствора содержат 98 г Н2SO4,
х г - “ - - “ - 51,55 г - “ - ,
 .
.
Объём 98% раствора
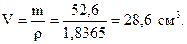
Определим массу воды, необходимую для приготовления раствора:
m=1031,5 – 52,6 =978,9 г.
Принимая плотность воды равной 1,0 г/см3, получим объём воды, необходимый для приготовления 1л 5% раствора. Он равен 978,9 мл.
Пример 1.19.Какой объём 2% соляной кислоты (ρ=1,008 г/см3) потребуется для получения 0,2866 г хлорида серебра в результате реакции с раствором нитрата серебра?
Решение. Из уравнения реакции
HCl + AgNO3 = AgCl↓ + HNO3
следует:
для получения 143,5 г AgCl необходимо 36,5 г HCl,
- “ - 0,2666 г - “ - - “ - х г - “ - ,
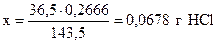 .
.
В 100 г раствора содержится 2 г HCl,
“ x г “ “ 0,0678 г HCl,
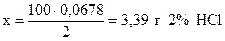 .
.
Объём 2% раствора соляной кислоты, необходимый для реакции, составит
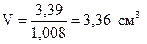 .
.
Контрольные задачи
1. Сколько граммов серной кислоты содержится в 500 г 10% раствора?
Ответ: 50 г.
2. Какой объём воды необходим для приготовления 200 г 5% раствора хлорида калия?
Ответ:190 см3.
3. Сколько граммов железного купороса (гептагидрат сульфата железа FeSO4 .7Н2О) необходимо для приготовления 600 г 8% раствора?
Ответ: 87,8 г.
4. Найдите массовую долю H2SO4 в растворе, полученном смешением 50 мл 6% (ρ=1,038 г/см3) и 250 мл 18% (ρ=1,124 г/см3) серной кислоты.
Ответ: 0,16.
5. Найдите массовую долю хлорида калия в растворе, полученном растворением 2 г KCl в 300 см3 5% раствора хлорида калия (ρ=1,030 г/см3).
Ответ: 0,108.
6. Какие объёмы 50% азотной кислоты (ρ=1,310 г/см3) и воды необходимо смешать для получения 1/2 л 10 % раствора HNO3 (ρ=1,054 г/см3)?
Ответ: 80,5 мл 50% HNO3 и 421,6 мл Н2О.
7. Какой объём 10% HNO3 (ρ=1,054 г/см3) потребуется для растворения 10 г карбоната кальция?
Ответ: 119,5 мл.
Основной курс
Дата добавления: 2016-10-07; просмотров: 2562;











