Образование и структура коллоидной мицеллы.
При конденсационном способе получения коллоидных растворов частицы дисперсной фазы в зависимости от условий образования могут приобретать положительный или отрицательный знак заряда. Например, при взаимодействии растворов KI и AgNО3 одинаковой концентрации, но при избытке AgNO3 вследствие образования осадка AgI по всему объему дисперсионной среды возникают мельчайшие частички иодида серебра, образуя ядро коллоидной мицеллы. Возникшие частицы растут за счет имеющихся в растворе ионов Ag+ и I-, чередуясь в последовательности AgIAgIAgIAg+... до тех пор, пока рост не приостановится из-за недостатка одного их этих ионов. В приведенном примере рост, очевидно, закончится тогда, когда все ионы I- будут закрыты ионами Ag+ на поверхности образовавшихся частиц, вследствие чего эта поверхность зарядится положительно. Такие ионы будут называться потенциалопределяющими. По правилу Панета-Фаянса, этими ионами могут быть только ионы, входящие в состав ядра и находящиеся в избытке. В данном случае это ион Ag+. Ядро мицеллы с роем потенциалопределяющих ионов получило название агрегат. Под действием электростатических сил притяжения к положительно заряженной поверхности (агрегату) притягиваются противоположно заряженные ионы из избытка. Рой противоионов, окружающих частицу, состоит из двух качественно неодинаковых слоев. Первый слой состоит из противоионов, находящихся под максимальным воздействием электрического поля частицы, а потому и менее подвижных, второй слой состоит из противоионов, более удаленных от поверхности частицы, а потому более подвижных, в силу чего этот слой ионов и называют подвижным или диффузным.
Такие частицы схематически записываются следующим образом:
{(AgI)m nAg+ (n-x)NO3-}х+ xNO3- ,
где (AgI)m - ядро коллоидной мицеллы, nAg+ - количество потен-циалопределяющих ионов, (n-x)NO3- - количество противоионов (компенсирующих) в неподвижном слое, xNO3- -количество противоионов в подвижном (диффузном) слое.
При избытке KI возникает тот же гидрозоль иодида серебра (AgI), но с отрицательно заряженными частицами:
{(AgI)mnI-(n-х)К+}х- хK+,
В этих условиях мицелла приобретает следующий вид (рис.16).
Распространяя приведенный пример на более широкий ряд подобных явлений, можно вывести следующее правило: при конденсационном пути образования коллоидных частиц они заряжаются знаком того иона, который

Рис. 16. Мицелла золя иодида серебра, полученного при избытке KI.
находится в избытке и который дает малорастворимое соединение с ионом,
входящим в состав коллоидной частицы. В полярной дисперсионной среде (вода) мицелла приобретает сольватную оболочку.
Зарядившаяся частица, вместе с роем противоионов, называется мицеллой, и является электронейтральной. Ядро мицеллы вместе с потенциалопределяющими ионами и противоионами неподвижного слоя называется гранулой, в отличие от мицеллы она несет электрический заряд.
В коллоидных системах на границе раздела дисперсная фаза - дисперсионная среда возникает двойной электрический слой (ДЭС).
Первая теория образования ДЭС была разработана Гельмгольцем, согласно которой двойной электрический слой состоит из двух слоев - один из которых расположен на твердой поверхности -потенциалопределяющие ионы, другой - в жидкой фазе параллельно поверхности на расстоянии молекулярного порядка от нее - обменные ионы, т.е. характер взаимодействия по типу плоского конденсатора (рис.17). Такая система в целом электронейтральна.
Гуи и Чэпмен выдвинули теорию диффузного расположения противоионов. По этой теории противоионы не могут быть сосредоточены только у межфазовой поверхности и образовывать моноионный слой, а рассеяны в жидкой фазе на некотором расстоянии от границы раздела. Такая

Рис.17. Распределение ионов в двойном электрическом слое («-» - потенциалопределяющие ионы, «+» - противоионы): I -по Гельмгольцу, II- по Гуи и Чэпмену, III- по Штерну (вверху -расположение ионов, внизу - кривые падения потенциала).
размытая структура двойного слоя определяется, с одной стороны, электрическим полем у «твёрдой» фазы, стремящимся притянуть эквивалентное количество противоположно заряженных ионов возможно ближе к твердой поверхности, а с другой стороны, тепловым движением ионов, вследствие которого противоионы стремятся рассеяться во всем объеме жидкой фазы. В зависимости от преобладания той или иной силы состояние противоионов оказывается неодинаковым. Действие электрического поля в непосредственной близости от межфазной границы преобладает, с удалением от нее сила поля ослабевает и проявляется все сильнее тепловое движение, рассеивающее противоионы двойного слоя, вследствие чего концентрация противоионов падает и становится равной концентрации тех же ионов, находящихся в жидкой фазе. Таким образом, возникает диффузный слой противоионов, связанный с твердой поверхностью, находящийся с ней в динамическом равновесии (рис.17 II).
Штерном была предложена схема строения ДЭС, в которой он объединил схемы Гельмгольца и Гуи - Чэпмена. Согласно Штерну, первый слой противоионов притягивается к твердой поверхности под влиянием как электростатических, так и адсорбционных сил, частично компенсируя φ0 - потенциал поверхности. В результате этого часть противоионов удерживается поверхностью на очень близком расстоянии, слой порядка 1-2 молекул, образуя плоский конденсатор (по теории Гельмгольца). Противоионы, нужные для полной компенсации потенциалопределяющих ионов, в результате теплового движения образуют диффузную часть двойного слоя. Толщина этого слоя может быть значительной и зависит от свойств и состава системы (рис.17 III). В настоящее время наиболее распространенной является схема ДЭС по Штерну.
Разность потенциалов между твердой поверхностью коллоидной частицы (ядро с роем потенциалопределяющих ионов) и раствором (два слоя противоинов), называется термодинамическим или полным - φ0 - потенциалом, величина его определяет размер мицеллы (кинетическую устойчивость).
Потенциал, который возникает на границе неподвижного и диффузного слоев противоионов, называется электрокинетическим или дзета-потенциалом (ζ). ζ - потенциал определяет агрегативную устойчивость коллоидной системы.
В то время как термодинамический потенциал представляет собой падение потенциала во всем двойном электрическом слое, электрокинетический потенциал - это падение потенциала в диффузной части ДЭС. Величина ζ - потенциала находится в прямой зависимости от степени размытости ДЭС, т.е. от его толщины; толщина ДЭС тем больше, чем меньше концентрация электролита в золе (рис.18).
Величина ζ - потенциала зависит от многих факторов, таких как температура, рН среды, концентрации электролита и золя и других. Экспериментально величину и знак ζ - потенциала можно определить по передвижению коллоидных частиц (электрофорез) или по передвижению
дисперсионной среды (электроосмос) в электрическом поле. Эти явления получили название электрокинетических явлений I порядка (под действием электрического поля движется дисперсная фаза или дисперсионная среда).

Рис.18. Зависимость ζ - потенциала и толщины диффузного слоя от концентрации электролита С (C4>C3>C2>C1), d - размер диффузного слоя противоионов.
Электрокинетические явления II порядка – это потенциал течения и
потенциал оседания (под действием движения дисперсной фазы или дисперсионной среды возникает электрический ток).
Экспериментальная часть:
Задание 1. Получение гидрозоля гидроокиси железа конденсационным методом (метод гидролиза).
В тщательно вымытой конической колбе емкостью 250 мл нагревают до кипения 100 мл дистиллированной воды. Затем в кипящую воду по каплям добавляют 10 мл 2% раствора хлорида железа (Ш) и кипятят раствор еще несколько минут.
После прибавления к кипящей воде раствора хлорида железа (Ш) образуется коллоидный раствор гидроокиси железа, окрашенный в интенсивно красно-коричневый цвет.
Реакция получения гидроокиси железа (Ш) идет по схеме:
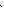 FeCl3 + 3H2O = Fe(OH)3 + 3HCl
FeCl3 + 3H2O = Fe(OH)3 + 3HCl
Поверхностные молекулы агрегата Fe(OH)3 вступают в химическое взаимодействие с НС1:
Fe(OH)3 + HC1 = FeOCl + 2H2O
Образующиеся в результате этой реакции молекулы хлорокиси железа, подвергаясь электролитической диссоциации, образуют ионы FeO+ + Сl-: FeOCl ↔ FeO+ + Сl-.
Таким образом, строение мицеллы гидроокиси железа можно изобразить следующим образом:
{[m(Fe(OH)3] • n FeO+ •(n-х)Сl- } • х Сl-
Как видно из схемы строения мицеллы, золь гидроксида железа (Ш) заряжен положительно.
Аналогичный опыт проделайте с холодной водой и ответьте, почему в этом случае не образуется коллоидный раствор.
Дата добавления: 2016-09-26; просмотров: 2677;











