РАСТВОРЫ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ. ОПРЕДЕЛЕНИЕ ИЭТ ГИДРОФИЛЬНОГО ЗОЛЯ ВИСКОЗИМЕТРИЧЕСКИМ МЕТОДОМ.
К высокомолекулярным соединениям (ВМС) относится обширный класс веществ, основным признаком которых является высокая молекулярная масса и большой размер молекул. Молекулярная масса их превосходит 10 000 у.е. и нередко достигает нескольких миллионов, а размер частиц в растворе составляет 10‾5 - 10ˉ8 м.
Свойства ВМС определяются не только их химическим составом, но и размерами и формой макромолекулы.
Высокомолекулярные соединения бывают:
1.Природные – натуральный каучук, естественные смолы. целлюлоза, крахмал, агар-агар, пектиновые вещества, белки;
2.Искусственные – природные ВМС, подвергшиеся химической обработке. В больших количествах они получаются в виде производных целлюлозы – нитроцеллюлоза, ацетилцеллюлоза, вискоза. Из них получают искусственную кожу, нитролаки, бездымный порох, искусственный шелк, негорючую кинопленку;
3.Синтетические ВМС – они синтезируются из низкомолекулярных соединений (мономеров) – различные типы искусственных каучуков, синтетических волокон, пластических масс, пленок, лаков.
Таким образом, ВМС получают 3 способами:
1.выделением из организмов или продуктов их жизнедеятельности;
2.частичной переработкой природных ВМС;
3.полным синтезом из исходных низкомолекулярных соединений.
В состав макромолекулы ВМС входят сотни и тысячи атомов. Атомы или их группировки могут располагаться в макромолекуле:
1.в виде длинной цепи – линейные ВМС
▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲▲
▲ – мономер.
например, целлюлоза, крахмал
…▬С6Н10О4▬О▬С6Н10О4▬О▬С6Н10О4▬…
а в с
а,в,с – мономеры; цепочка целлюлозы содержит от 100 до 700 отдельных звеньев – глюкозных остатков С6Н10О5 , связанных между собой главными валентными связями.
2. длинные цепи с разветвлением – разветвленные ВМС:
╟╡╣╟╫╦╦╨╨╨╨╟╟╟╤╤╤╩╩╩╩╩╞╞╞╓╓╓
например, аминопектин;
3.В виде трехмерной сетки, состоящей из отрезков цепного строения – сшитые ВМС:









 ────────────────────────────────
────────────────────────────────
────────────────────────────────
────────────────────────────────
────────────────────────────────
например, фенолоальдегидные смолы.
Механические свойства ВМС представляют собой сочетание свойств твердых тел и жидкостей. Они прочны; способны к высокоэластичным деформациям; вытягиваются в длинные тонкие нити; набухают в низкомолекулярных жидкостях. Растворы ВМС способны образовывать системы, промежуточные между твердым и жидким состояниями, так называемые, студни. ВМС способны образовывать волокна, пленки; растворы ВМС отличаются повышенной вязкостью.
По своим свойствам растворы ВМС напоминают коллоидные системы. Именно поэтому вплоть до 60 годов прошлого столетия, растворы ВМС рассматривали как один из классов коллоидных систем. Учитывая их высокую агрегативную устойчивость, обусловленную активным взаимодействием ВМС с растворителем, их назвали лиофильными коллоидами, в случае водных растворов – гидрофильными коллоидами. В настоящее время однозначно признается, что растворы ВМС золями не являются, т.к. представляют собой однофазные (гомогенные или однородные) истинные растворы, в которых растворенное вещество распределено в растворителе не в виде твердых или жидких частиц, а в виде молекул или ионов. Растворы ВМС неотличимы от растворов низкомолекулярных соединений, но из-за гигантских размеров своих молекул по некоторым свойствам напоминают золи.
Процесс растворения ВМС происходит самопроизвольно, поэтому эти растворы называются истинными растворами высокомолекулярных соединений. Растворы ВМС представляют собой молекулярно-дисперсные системы – растворенное вещество в них находится в виде гибких макромолекул с цепочечным строением. Растворы ВМС – гомогенные однофазные системы, способные сохранять свою молекулярную концентрацию и агрегативную устойчивость неопределенно долгое время.
Все процессы в растворах ВМС, связанные с изменением температуры, концентрации и давления, совершаются обратимо. Если, например, процесс коагуляции в растворах лиофобных коллоидов – процесс необратимый, то в растворах ВМС – он обратим.
Растворы высокомолекулярных соединений, будучи истинными растворами, имеют некоторое сходство с растворами лиофобных коллоидов:
1.гигантский размер макромолекулы;
2.своеобразное тепловое движение их подобно броуновскому;
3.отсутствие способности к диализу;
4.слабо выраженные молекулярно-кинетические свойства;
5.размытый конус Тиндаля.
Из природных ВМС обширную и исключительно важную группы представляют белки, или протеины. Они играют первостепенную роль во всех жизненных процессах и являются той основой, из которой состоят все части отдельной клетки и целого организма.
Химическая природа белков отличается большой сложностью. Известно, что белковая макромолекула построена из остатков α-аминокислот, соединенных друг с другом пептидными связями:
[─СО─NH▬]
 Пример цепи белковой молекулы:
Пример цепи белковой молекулы:
 …СН─СО─NH─CH─CO─NH─CH─CO─…
…СН─СО─NH─CH─CO─NH─CH─CO─…
│ │ │
R1 R2 R3
R1, R2, R3 – боковые группы аминокислотных остатков.
В связи с тем, что в состав белковых молекул входят остатки примерно 20 аминокислот, число возможных сочетаний их исключительно велико.
Существуют простые и сложные белки:
Простые белки состоят только из аминокислотных остатков, к ним относятся, например глиадин, альбумин, желатин и др. Так, для альбумина молока с молекулярным весом около 17 000 у.е. характерно число звеньев не менее 150, а для яичного белка с молекулярным весом около 43 000 у.е. – 400. Таким образом, белки по составу представляют собой сложные полипептиды, а по строению - высокополимеры.
Сложные белки - состоят из протеинов α- аминокислот, соединенных с остатками полисахаридов, ортофосфорной кислоты, катионов металлов и др. К ним относятся:
1.гемоглобин, содержащий железопорфириновый комплекс;
2.гликопротеиды, в состав которых входят молекулы углеводов;
3.липопротеиды – белковый комплекс с жирами и стероидами;
4.никлеопротеиды, состоящие из белковых молекул и нуклеиновых кислот (в состав нуклеиновых кислот входят остатки фосфорной кислоты, сахаридов, пуриновые и пиримидиновые основания (РНК, ДНК)).
Как показали многочисленные исследования, все белки можно разделить на две большие группы: фибриллярные и глобулярные. Фибриллярные - имеют вид волокон или длинных нитей, обычно соединенных между собой (от латинского fibrilla – волоконце). К ним относятся коллаген и эластин – белки хрящей и костей, кератин – белок рогов животных, волос, мышц. В организме они выполняют в основном механические функции. Однако, сократительный белок мышц – миозин обладает определенной биологической активностью, являясь ферментом. Фибриллярные белки при комнатной температуре в воде нерастворимы, но в ней набухают.
Глобулярные белки находятся главным образом в биологических жидкостях – в крови, лимфе, протоплазме клеток и т.п. Они состоят из макромолекул шаровидной, эллипсоидальной формы (от латинского – globula – шарик). На них обычно возлагаются важные биологические функции в клетке, ткани, организме, связанные с основными жизненными процессами (обмен веществ, питание и т.п.). К ним относятся альбумины и глобулины яичного белка, молока, сыворотки крови и др.
Белковые макромолекулы содержат в своем составе значительное количество полярных (гидрофильных) радикалов, характеризующихся большой активностью к воде - [-СООН], [-NH2], [-CO-NH-] и др. В связи с этим белковые вещества относятся к числу высокогидрофильных органических коллоидов.
Наличие в аминокислотах, из которых состоят белки, двух полярных групп – основной NH2 и кислотной – СООН – сообщает белкам амфотерные свойства. Белки не просто электролиты, а электролиты-амфолиты. Это значит, что в водных растворах их макромолекулы способны диссоциировать в двух направлениях: и как кислота, т.е. с отщеплением свободных ионов водорода по уравнению:
NH2 –R - COOH↔ H+ + NH2- R - COO‾
И как основание, т.е. с отщеплением ионов гидроксила:
NH2 – R – COOH + H2O ↔ OH‾ + NH3+- R – COOH
Если растворять белки в чистой воде, то золи большинства из них обнаруживают кислотный характер, что указывает на преобладание кислотной диссоциации большинства белков над основной. Имеются также белки, например, глобин, которые в водном растворе обнаруживает преобладание основного типа диссоциации. Следует отметить, что как кислотные, так и основные свойства белковых макромолекул выражены очень слабо, так как белковые вещества являются лишь слабыми электролитами.
Гигантские молекулы белков и продукты их ассоциации обладают способностью легко перезаряжаться, что достигается путем изменения реакции среды. Изменяя рН среды, можно создать такие условия, при которых суммарный заряд белковой молекулы будет равен нулю. Такое состояние называется изоэлектрическим, а значение рН, при котором система находится в изоэлектрическом состоянии, называется изоэлектрической точкой (ИЭТ).
В изоэлектрическом состоянии свойства растворов белков резко меняются: они имеют наименьшую растворимость, наименьшую вязкость, что связано как с изменением формы макромолекулы, так и степени ее гидратации. При значении рН, близком к изоэлектрической точке, разноименно заряженные группы [-NH3+] и [-СОО‾]притягиваются друг к другу и нить закручивается в спираль. При смещении рН среды от ИЭТ одноименно заряженные группы отталкиваются друг от друга и цепь выпрямляется (рис.21)
Положение ИЭТ различных белков колеблется в широких пределах (рН от 4 до 12). Это объясняется тем, что способность группы [–СООН] к отщеплению иона Н+ выше способности присоединения этого иона к группе [–NH2]. В настоящее время принято выражать изоэлектрическую точку в показателе концентрации водородных ионов – рН (таблица 26).

Рис.21. Форма отдельных участков цепи макромолекулы
белка при различных значениях рН.
Таблица 26
Изоэлектрическая точка некоторых белков
| название белка | ИЭТ в рН | Название белка | ИЭТ в рН |
| Пепсин Желатин Альбумин сыворотки крови Фибриноген Яичный альбумин Казеин α-глобулин плазмы β-глобулин плазмы | 2.5-3.3 4.6-4.7 4.6-4.7 5.4 4.6-4.7 4.7 4.8 5.2 | γ-глобулин плазмы Оксигемоглобин Глобин лошади 5 лет Глобин лошади 9 лет Глобин мужчины Глобин женщины Фибрин Глиадин пшеницы | 6.4 6.8 7.24-7.48 7.06-7.17 7.25-7.35 7.17-7.25 5.00 9.80 |
Одним из характерных свойств коллоидных систем является вязкость.
Вязкость - это внутреннее трение жидкости, которое испытывает один слой жидкости относительно другого при истечении. Сила трения f пропорциональна поверхности S и градиенту скорости 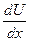 , т.е.
, т.е.
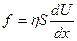 , (закон Ньютона)
, (закон Ньютона)
где h («этта») - коэффициент внутреннего трения, который называют вязкостью (динамической вязкостью). Отсюда:
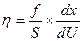
В системе СИ единицей измерения вязкости является [Па×с], часто применяют и несистемную единицу – [ 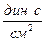 ], получившую название пуаз [П]; 1 П = 0,1 Па с.
], получившую название пуаз [П]; 1 П = 0,1 Па с.
Вязкость гидрофобного золя зависит от концентрации золя и не зависит от способа его приготовления. Вязкость гидрофобного золя всегда выше вязкости дисперсионной среды.
Относительная вязкость гидрофобных коллоидов описывается уравнением Эйнштейна:
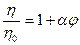
где h и h0 - вязкость золя и дисперсионной среды соответственно,j - объемная концентрация дисперсной фазы, a - коэффициент, учитывающий форму частиц дисперсионной фазы.
Если коллоидные мицеллы имеют сферическую форму, то уравнение Эйнштейна принимает вид:
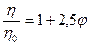
Графически изменение вязкости гидрофобного золя от концентрации изображается прямой линией (рис.17, кривая 2).
Гидрофильные коллоиды, частицы которых значительно сольватированы (гидратированы), имеют большую вязкость, чем гидрофобные коллоиды равной концентрации (рис.22, кривая 1). Их вязкость резко возрастает с увеличением концентрации золя.

Рис. 22. Зависимость вязкости гидрофильных (1) и гидрофобных (2) коллоидов от концентрации
При расчете относительной вязкости 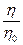 лиофильных систем необходимо вводить поправку на объём сольватных оболочек, включая его в объём дисперсной фазы. Тогда уравнение Эйнштейна для лиофильных систем примет вид:
лиофильных систем необходимо вводить поправку на объём сольватных оболочек, включая его в объём дисперсной фазы. Тогда уравнение Эйнштейна для лиофильных систем примет вид:
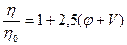 ,
,
где V- объем сольватных оболочек частиц дисперсной фазы.
При постоянной концентрации гидрофильного золя его относительная вязкость может меняться с изменением гидратации частиц дисперсной фазы. Гидратация гидрофильных коллоидов обусловлена наличием в их частицах полярных и ионогенных групп и зависит от рН среды. Для белков основными такими группами являются -NH2 и -СООН. Схематически белковую молекулу, обладающую коллоидными свойствами, можно изобразить так:
 Суммарный заряд белковой макромолекулы определяется соотношением числа кислотных групп (СОО-) и основных (NH3+). Изменяя рН раствора, можно создать такие условия, при которых суммарный заряд белковых молекул будет равен 0. Такое состояние белков называется изоэлектрическим, а рН, при котором оно осуществляется, изоэлектрической точкой (ИЭТ).
Суммарный заряд белковой макромолекулы определяется соотношением числа кислотных групп (СОО-) и основных (NH3+). Изменяя рН раствора, можно создать такие условия, при которых суммарный заряд белковых молекул будет равен 0. Такое состояние белков называется изоэлектрическим, а рН, при котором оно осуществляется, изоэлектрической точкой (ИЭТ).
Поскольку величина гидратации пропорциональна величине суммарного заряда макромолекулы, то в изоэлектрическом состоянии лиофильные коллоиды имеют минимальный сольватный объем и, в соответствии с уравнением Эйнштейна, минимальную вязкость. Например, для раствора желатина изоэлектрическое состояние, а, следовательно, и минимальная вязкость, наблюдаются при рН = 4,7 (рис.23).

Рис. 23. Зависимость вязкости гидрофильных коллоидов от рН среды
Изменяя рН среды, можно влиять на вязкость раствора ВМС. Например, увеличение вязкости желатина при уменьшении рН среды (переход в более кислую область от изоэлектрической точки) объясняется увеличением положительного заряда белковой молекулы за счет протонирования нейтральных аминных групп (-NH3+), что сопровождается увеличением гидратации и, следовательно, вязкости (рис.). При максимальной вязкости в кислой области белковая молекула схематически может быть представлена так:

При дальнейшем уменьшении рН, когда прореагируют все нейтральные аминогруппы, ионизация (заряд) молекулы начинает уменьшаться за счет присоединения ионов водорода к карбоксильным анионам. Этот процесс сопровождается уменьшением гидратации, а, следовательно, и вязкости.

При дальнейшем уменьшении рН в сильнокислой среде начинается деструкция белка (кислотный гидролиз), белок начинает распадаться на отдельные аминокислоты.
При увеличении рН от изоэлектрической точки (переход в более щелочную область) происходит увеличение суммарного отрицательного заряда за счет диссоциации карбоксильных групп, что приводит к увеличению отрицательных зарядов на поверхности макромолекулы. Следствием этого, опять-таки, является увеличение гидратации макромолекул и вязкости растворов ВМС. При максимальной вязкости в щелочной области белковая молекула схематически представляется так:

Дальнейшее увеличение рН вызывает уменьшение ионизации макромолекулы за счет отщепления иона водорода от заряженной аминогруппы, что сопровождается уменьшением гидратации и вязкости.

При дальнейшем увеличении рН в сильнощелочной среде начинается деструкция белка (щелочной гидролиз), белок начинает распадаться на отдельные аминокислоты, что сопровождается уменьшением гидратации.
Существует несколько способов измерения вязкости. Для жидкостей с небольшой вязкостью наиболее распространенным является способ измерения вязкости с помощью капиллярного вискозиметра Оствальда.
Измерение вязкости в приборе Оствальда основано на определении времени истечения определенного объема жидкости через капилляр. Данный метод измерения является относительным, в качестве стандарта используется дистиллированная вода с известной вязкостью h0. Измерив время истечения воды t0 и исследуемой жидкости t, вычисляют вязкость последней h:
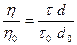
откуда:
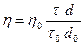
где d0 - плотность воды, d - плотность исследуемой жидкости.
Если используют водные разбавленные растворы, можно принять d0 = d, тогда
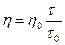
Так как вязкость зависит от температуры, то измерение её проводят при постоянной температуре, которая поддерживается с помощью водяного термостата.
Характерным свойством высокомолекулярных соединений является набухание, то есть проникновение молекул растворителя в среду высокомолекулярного соединения и связанное с этим увеличение его массы и объема.
Одно и то же вещество может набухать в нескольких жидкостях (растворителях), но в различной степени. Так, каучук лучше набухает в сероуглероде и хлороформе, чем в эфире и нитробензоле.
Различают ограниченное и неограниченное набухание. Неограниченное набухание – это набухание, которое в конечном итоге заканчивается растворением ВМС. В качестве примера неограниченного набухания можно назвать растворение белка в воде или каучука в бензине. Ограниченное набухание – это набухание, которое не доходит до стадии растворения. В этом случае ВМС поглощает низкомолекулярную жидкость, но само в ней не растворяется или растворяется очень мало, образуя студень. В качестве примера ограниченного набухания можно назвать набухание желатина в воде при комнатной температуре.
Скорость набухания ВМС зависит от целого ряда факторов: давления, температуры, рН среды, присутствия посторонних электролитов, степень измельчения и возраста (свежести) ВМС.
Способность ВМС к набуханию в различных жидкостях и в различных условиях с количественной стороны может быть охарактеризовано степенью набухания – это отношение массы поглощенной низкомолекулярной жидкости к массе ВМС до набухания.
ВМС, увеличиваясь в объеме при набухании, оказывает определенное давление на стенки сосуда, в котором оно находится. Это давление называется давлением набухания. В ряде случаев давление набухания достигает десятков и даже сотен Паскалей. Так, сухой горох, помещенный в сосуд с водой, при набухании может разорвать сосуд. Эту силу давления гороха используют в анатомических музеях для расчленения костей черепа. Известны случаи гибели пароходов, груженных бобами или горохом, когда после образования пробоин и проникновения воды в трюм, происходило их набухание и разрыв бортов судна. Большую силу давления можно наблюдать при набухании клина из сухого дерева, вбитого в трещину каменной глыбы или бревна и затем смоченного водой.
Измерение давления набухания может быть произведено на приборе Позднякова.
Биологическое значение:
Вязкость – это движение одного слоя жидкости относительно другого при истечении. Таким образом, где бы ни происходило движение жидкостей в биологических системах, важное значение имеет их вязкость. Классическим примером такого движения является движение крови в артериях, венах и капиллярах кровеносных сосудов у высших животных и человека. Скорость течения крови через большую аорту во времени так велика, что течение приближается к условиям турбулентности. Эритроциты играют большую роль в вязкости крови: так при 37ºС вязкость цельной человеческой крови составляет 0,03 – 0,04 пуаз, а вязкость плазмы около 1 пуаза. Известна зависимость вязкости крови от скорости течения, а именно – падение вязкости при увеличении скорости течения.
От величины вязкости зависит течение биологических жидкостей в растительных и животных организмах, что часто наблюдается в протоплазме. Наглядный пример протоплазматического течения дает миксомицет Physarum polycephalum, где течение протоплазмы сопровождается изменением очертаний плазмодия в целом.
Набухание имеет большое значение не только в природе, но и в жизнедеятельности человека, а также во многих производствах. Целый ряд физиологических процессов, таких как сокращение мышц, образование опухолей и др. имеют в своей основе явления набухания. Способность кожи и волокнистых веществ растягиваться при набухании и сокращаться при высыхании широко используется в кожгалантерейном производстве, при изготовлении обуви, одежды и других изделий.
В пищевой промышленности обработка большей части продуктов питания – муки, круп, овощей, мяса и т.д. сводится в основном к процессу набухания.
Главный прием в кулинарии – варка с обычным применением повышенных температур – является типичным процессом набухания. Начальный этап самого акта пищеварения, совершающийся в полости рта и в желудке человека и животных, является в известной мере также процессом набухания, сопровождающимся действием механических и химических факторов, увеличивающих степень и скорость набухания.
Большое значение имеет набухание в процессах жизнедеятельности растительных и животных организмов. Прорастанию семян всегда предшествует предварительное набухание. Растительные и животные ткани связывают большое количество воды (соединительная ткань) и содержат коллоиды не только в виде растворов, но и в студнеобразном состоянии (протоплазма клеток, хрусталик глаза и др.).
Чередование в зависимости от рН среды и концентрации электролитов процессов набухания и обезвоживания соединительной ткани влияет на распределение воды, а также ионов между соединительной тканью и клетками. Так, при рН среды, вызывающей набухание клеток, вода поступает в них из «водного депо» – соединительной ткани, которая при этом обезвоживается.
Набухание и обезвоживание коллоидов также наблюдается при самых различных процессах: регенерации тканей, воспалении, образовании отеков, при проникновении кислых жидкостей в ткани, при ожоге кожи крапивой, при укусе насекомых и т.п. Во всех указанных случаях набухания зависит, главным образом, от изменения в тканях рН среды.
С процессом набухания связано старение растительных и животных организмов в целом.
Список литературы.
1. Алёшин С.Н. Руководство к практическим занятиям по физической и коллоидной химии (учебное пособие). Москва, изд-во ТСХА. – 1952.
2. Болдырев А.И. Физическая и коллоидная химия. Москва, изд-во «Высшая школа». – 1983.
3. Равич-Щербо М.И., Анненков Г.А. Физическая и коллоидная химия. Москва, изд-во «Высшая школа». – 1968.
4. Руцков А.П. Краткий курс коллоидной химии. Ленинград, ГОСХИМИЗДАТ. – 1958.
Дата добавления: 2016-09-26; просмотров: 2142;











