Область коллоидного состояния.
Коллоидная химия является отраслью науки, посвященной изучению особых дисперсных систем – коллоидов. Однако понятие «коллоид» или «коллоидная система» требует уточнения, так как в разные времена и разными учеными в это понятие вкладывался неодинаковый физический смысл, а вместе с тем неодинаковые задачи и содержание приписывались и самой коллоидной химии.
В связи с этим и термин «коллоидная химия» в настоящее время является несколько устаревшим, так как она значительно меньше занимается химическим составом коллоидных систем и химическими реакциями в них, чем физической структурой, физическими (и даже механическими) свойствами и физико-химическими процессами, характерными для этих систем. Поэтому правильнее именовать ее физико-химией коллоидных систем. Поскольку, однако, в настоящее время круг изучаемых ею дисперсных систем весьма расширился, то точнее было бы именовать ее и еще более общим термином – физической химией дисперсных систем.
Область современной коллоидной химии дисперсных систем, помимо лиофобных золей, высокомолекулярных соединений и их растворов, суспензий, эмульсий, пен, аэрозолей и твердых золей, включает еще одну практически важную группу дисперсных систем, получившую наименование «полуколлоидов».
В эту группу входят вещества, способные с одним и тем же растворителем, в зависимости от концентрации и температуры, давать и молекулярные растворы и типичные золи; к ним относятся мыла, красители и дубильные вещества.
Приведем следующее наиболее современное определение коллоидной химии, принадлежащее И.И.Жукову:
Коллоидная химия ставит своей задачей изучение физико-химических свойств:
а) всех высокодисперсных гетерогенных систем, кладя в основу поверхностные явления на границе фаз;
б) высокомолекулярных и высокополимерных соединений – как в твердом состоянии, так и в состоянии раствора.
Значение коллоидной химии исключительно велико, так как в ней изучаются не только общие вопросы познания физической сущности окружающего нас материального мира, но и вопросы, тесно и непосредственно связанные с проблемами самой жизни, поскольку все живое состоит из сложнейших комплексов веществ в коллоидном состоянии.
Трудно назвать ту отрасль промышленности, в которой в наше время коллоидная химия не находила бы своего практического применения. Такие, например, отрасли промышленности и производства, как пищевая, текстильная, искусственного волокна, кожевенная, резиновая, синтетического каучука, пластмасс, лакокрасочная, мыловаренная, взрывчатых веществ, целлюлозно-бумажная, гидролизная, фармацевтическая, обогащения руд (флотация) – самым тесным образом связаны с коллоидно-химическими процессами. Даже в таких отраслях промышленности, очень далеких, казалось бы, от коллоидной химии, как металлургическая, горнодобывающая, нефтедобывающая и нефтеперерабатывающая, силикатная и строительных материалов, все шире внедряются методы коллоидной химии.
Огромное значение имеют коллоиды и коллоидные процессы, и их изучение в сельском хозяйстве, в первую очередь для почвоведения – в вопросах повышения плодородия почв.
Велико их значение и в медицине.
В практической деятельности мы редко встречаемся с чистыми веществами, состоящими из одного компонента. Природные воды, большинство минералов, физиологические жидкости (клеточный сок растений, молоко, кровь и др.) содержат несколько компонентов.
Системы, содержащие одно или несколько веществ в виде частиц (дисперсная фаза), распределенных в той или иной среде (дисперсионная среда), называются дисперсными (от латинского dispersus). Слово "дисперсность" означает измельчение, раздробление.
Эти системы делятся на однофазные - гомогенные и многофазные - гетерогенные. Все молекулярно-ионные растворы относятся к гомогенным однофазным системам и называются истинными растворами.
В основу классификации гетерогенных дисперсных систем положены следующие признаки:
1. степень дисперсности, т.е. размер частиц дисперсной фазы;
2. агрегатное состояние фаз;
3. интенсивность взаимодействия частиц дисперсной фазы с
дисперсионной средой. ,
1. Различают три класса дисперсных гетерогенных (неоднородных) систем, отличающихся размерами частиц (d) дисперсной фазы:
a) микрогетерогенные или грубодисперсные системы, d>10-7м
(суспензии, эмульсии, порошки и др.);
b) коллоидные или улътрамикрогетерогенные системы, 10-9 < d < 10-7м;
c) истинные растворы, d < 10-9м.
Дисперсные системы, размер частиц дисперсной фазы которых лежит в пределах от 10-9 до 10-7м, относятся к коллоидно-дисперсным и являются основным объектом изучения коллоидной химии.
Таким образом, коллоидными системами называются полидисперсные гетерогенные системы с величиной частиц дисперсной фазы от 10-7 до 10-9 м.
Структурной и кинетической единицей коллоидных систем является не ион и не молекула в обычном смысле, а либо комплекс (агрегат), состоящий из большого числа обычных молекул, атомов или ионов, называемых мицеллой, либо макромолекула, т.е. молекула-полимер «гигантских» размеров, обладающая молекулярным весом в десятки и сотни тысяч углеродных единиц.
2. По агрегатному состоянию различают дисперсные системы с газообразной, жидкой и твердой дисперсионной средой. Дисперсные системы с газообразной дисперсионной средой называются аэрозолями (дым, туман). Водные коллоидные растворы называются гидрозолями, спиртовые - алкозолями, эфирные -эфирозолями и т.д. Затвердевший золь, или отделившаяся от дисперсионной среды дисперсная фаза образует гель.
Каждая дисперсная фаза и дисперсионная среда могут быть в трех агрегатных состояниях: газообразном, жидком и твердом. Исходя из этого, можно было бы ожидать существования в природе девяти групп различных дисперсных систем, но система газ в газе не образует агрегатов, а представляет собой гомогенную смесь, не имеющую поверхности раздела между фазами (табл. 21).
Таблица 21
Дисперсные системы
| Дисперсионная среда | Дисперсная фаза | Система | |
| Газ | Жидкость | Туман, облака | |
| Газ | Твёрдое тело | Дым, пыль | |
| Жидкость | Газ | Пена | |
| Жидкость | Жидкость | Эмульсии (молоко, маргарин) | |
| Жидкость | Твёрдое тело | Суспензии, Коллоиды | |
| Твёрдое тело | Газ | Пемза, хлеб | |
| Твёрдое тело | Жидкость | Жемчуг | |
| Твёрдое тело | Твёрдое тело | Рубин, голубая каменная соль | |
| ■ |
3. По интенсивности взаимодействия между частицами дисперсной фазы и дисперсионной средой различают два класса коллоидных систем: лиофилъные (от греческих лио - растворяю и филио - люблю) системы и лиофобные (от греческих лио - растворяю и фобос - страх) системы.
Лиофильными коллоидными системами являются такие системы, в которых частицы дисперсной фазы прочно связывают большое количество молекул растворителя и также прочно удерживают их, если коллоид выделяется из раствора.
Лиофильные системы (растворы высокомолекулярных соединений) вследствие их «любви» к растворителю образуются самопроизвольно. Так, при помещении кусочка сухого желатина или крахмала (состояние геля) в воду через некоторое время в результате гидратации геля образуется коллоидный раствор (золь).
Лиофобными коллоидными системами являются такие системы, в которых частицы дисперсной фазы очень слабо взаимодействуют с молекулами растворителя.
Для получения золя гидрофобного коллоида необходимо затратить работу (химическую - получение нерастворимого вещества в ходе реакции, или физическую - растирания и др.).
Коллоидные растворы обнаруживают ярко выраженные оптические свойства. Простое наблюдение показывает, что растворы лиофильных коллоидов всегда мутные (раствор желатина, альбумина и др.), а растворы лиофобных коллоидов почти всегда имеют окраску ( гидрозоль гидроокиси железа - красно-коричневую; гидрозоль берлинской лазури - синюю).
Было установлено, что при прохождении света через коллоидный раствор, коллоидные частицы рассеивают свет и тем больше, чем больше их число и сильнее интенсивность света. Этот эффект получил название конуса Тиндаля, а интенсивность свечения выражается законом Рэлея:
I = I0 k 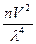
где I - интенсивность рассеянного света; Iо - интенсивность падающего света; k - константа, зависящая от разности показателей преломления дисперсной фазы и дисперсионной среды; n - число частиц в единице объема, т.е. концентрация частиц золя; V-объём частицы дисперсной фазы; λ - длина волны падающего света.
Конус Тиндаля в коллоидном растворе является выражением эффекта светорассеяния. Светорассеяние достигается только тогда, когда величина частицы, рассеивающей свет, начинает приближаться к величине длины световой волны. Истинные растворы таким свойством не обладают. По этому свойству легко отличить истинные растворы от коллоидных.
Так как молекулы некоторых веществ по своим размерам могут быть близки к размерам коллоидных частиц, то с этой точки зрения трудно провести резкую границу между истинными и коллоидными растворами. Все же между ними имеется существенное различие: в то время как истинные растворы - термодинамически устойчивые системы, устойчивость коллоидных растворов с большей или меньшей скоростью меняется во времени.
Коллоидные растворы представляют собой гетерогенные системы, что и служит одной из причин их неустойчивости. Коллоидные растворы обладают большой свободной энергией поверхности и в соответствии со вторым началом термодинамики стремятся к равновесному состоянию, характеризующемуся разделением системы на две фазы, имеющие минимальные межфазовые поверхности и, следовательно, минимальную свободную поверхностную энергию.
Устойчивость характеризуется длительностью нахождения системы в неизменном состоянии. Различают кинетическую и агрегативную устойчивость коллоидных систем.
Кинетическая устойчивость характеризуется временем сохранения равномерного распределения частиц дисперсной фазы по всему объёму дисперсионной среды.
Агрегативная устойчивость характеризуется временем сохранения неизменной степени дисперсности (раздробления частиц) дисперсной фазы коллоидной системы.
С помощью ультрамикроскопа было установлено, что коллоидные частицы находятся в интенсивном броуновском движении. Чем мельче частицы, тем интенсивнее движение, и наоборот, чем крупнее, тем меньше скорость их движения. Одновременно с этим частицы находятся под влиянием силы земного притяжения.
Таким образом, коллоидные частицы находятся под воздействием двух взаимно противоположных сил: броуновского движения, стремящегося равномерно распределить частицы по всему объему дисперсионной среды, и силы тяжести, стремящейся собрать эти частицы на дне сосуда. Чем крупнее частицы, тем сильнее проявляется действие земного тяготения, тем скорее они отделяются от дисперсионной среды и тем меньше их кинетическая устойчивость.
В природе коллоидные системы образуются двумя путями: конденсационным и дисперсионным. Воспроизведение этих путей и лежит в основе методов получения коллоидов.
В первом случае коллоиды получаются за счет соединения (конденсации) ионов или молекул с образованием более крупных частиц. Причиной вызывающей образование таких частиц является пересыщенное состояние данного вещества в среде другого вещества, в котором первое находится в растворенном состоянии. Так, например, при понижении температуры воздуха, насыщенного водяными парами, создается пересыщение, которое сопровождается образованием тумана; при сливании спиртового раствора канифоли с водой, образуется золь мастики, так как канифоль трудно растворяется в воде и вследствие этого образуются частицы канифоли коллоидных размеров.
Во втором случае - коллоиды образуются за счет раздробления (диспергирования) крупных частиц до частиц коллоидных размеров. Так, например, для раздробления глинистых минералов применяют шаровые мельницы, представляющие собой эксцентрически вращающиеся барабаны из прочной стали, частично заполненные шарами из того же материала.
Так как почвы в большинстве случаев представляют собой мелкие комочки из слипшихся между собой отдельных частиц, в том числе и коллоидных, то для разделения их на отдельные более мелкие частицы применяют химический метод раздробления. В этом случае в качестве реагента обычно употребляют растворы различных солей натрия и щелочей. Такой метод раздробления получил название пептизации.
Полученные коллоидные растворы очищают от примесей электролитной природы посредством диализа. Диализ основан на способности полупроницаемых мембран пропускать частицы истинных растворов и не пропускать коллоидные частицы, поскольку размер пор полупроницаемой мембраны меньше чем d частицы. Диализ продолжают до отсутствия качественной реакции на определяемые ионы или молекулы. Другим методом очистки коллоидных растворов является ультрафильтрация.
Дата добавления: 2016-09-26; просмотров: 1604;











