Задание 2. Определение теплового эффекта реакции окисления
металлического цинка и восстановления ионов меди в водном растворе
Тепловые эффекты реакций измеряются так же, как постоянная калориметра. Тепловой эффект вычисляется по уравнению
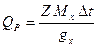
Исследуемая реакция является окислительно-восстановительной, и механизм её заключается в переносе электронов от металлического цинка к ионам меди согласно уравнению
Cu2+ + Zn0 = Cu0 + Zn2+ + Qp
Измеряемый тепловой эффект будет равен Qp = DH. Данный процесс необратим, т.к. цинк, переходя в раствор, не восстанавливается, и реакция идет до полного исчезновения ионов меди в растворе с эквивалентной заменой их на ионы цинка.
400 мл 0,05 М раствора CuSО4×5H2O наливают в стакан Б калориметра. Закрывают сосуд А так, чтобы нижние концы термометра и мешалки не доставали дна стакана Б на 1 - 2 см. Включают мотор мешалки и измеряют температуру, точно следуя тем записям, которые проводились при измерении водяного числа (постоянной калориметра). На 11-й минуте через воронку в стакан В высыпают 3 г цинковой пыли.
По полученным данным строят график изменения температуры и находят Dt (рис.6).
Тепловой эффект реакции рассчитывают по уравнению
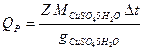 ,
,
где gCuSO4 5H2O – количество кристаллогидрата, содержащегося в 400 мл 0,05 М раствора.
Тепловой эффект химической реакции является следствием изменения внутренней энергии реагирующих веществ и без воздействия внешних сил на

Рис. 6. Графическое определение Dt для вычисления теплового эффекта реакции.
условия протекания реакции она полностью превращается в теплоту. Если эта реакция осуществляется в гальваническом элементе, то часть внутренней энергии будет превращаться в полезную работу. Эта работа будет максимальной, когда химический или физический процесс протекает изотермически и обратимо. Именно этим условиям соответствуют процессы, протекающие в гальванических элементах. Реакция окисления Zn и восстановления Cu2+ наблюдается в элементе Даниэля - Якоби:
Cu | Cu2+ | KCl | Zn2+ | Zn
Максимальная работа по перенесению заряда равна (Дж×моль-1)
W = n × F × E ,
где n – число переносимых электронов, F - число Фарадея (96500 Кл), E - электродвижущая сила (1,10 В). Максимальная работа равна, но противоположна по знаку изменению свободной энергии DG. Следовательно, DG процесса можно рассчитать по уравнению
W = - DG
Свободная энергия является частью энтальпии и связана с ней соотношением DG = DH - T×DS, где T×DS – связанная энергия. Зная DH и DG, можно рассчитать энтропию окисления цинка и восстановления ионов меди по уравнению
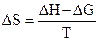 ,
,
где Т – температура, при которой проводился эксперимент (температура окончания реакции окисления Zn с точностью до 10). При расчете DS следует свободную энергию (DG) и тепловой эффект реакции (DH) привести в единую систему измерения величин, т.е. тепловой эффект, рассчитанный в калориях перевести в джоули (1 калория = 4,18 Дж).
Таблица 15
Определение Z
Масса KCl 7,2 г
| Периоды, мин | |||||
| Предварительный | Главный | Заключительный | |||
| Время, мин | Температура, град | Время, мин | Температура, град | Время, мин | Температура, град |
| 10,5 11,5 12,5 13,5 14,5 |
Таблица 16
Определение теплового эффекта реакции
| Периоды, мин | |||||
| Предварительный | Главный | Заключительный | |||
| Время, мин | Температура, град | Время, мин | Температура, град | Время, мин | Температура, град |
| 10,5 11,5 12,5 13,5 14,5 |
Таблица 17
Результаты вычислений
| Опыт | Dt, OC | Z | QP, ккал/моль | DG, кДж/моль | DS, Дж/моль К |
| Определение Z | ___ | ___ | |||
| Определение QP | ___ |
Дата добавления: 2016-09-26; просмотров: 2217;











