Коррозия некоторых металлов и сплавов в различных средах
| Материалы | HF (газ) | HF (раствор) | NH3 (газ) | СО2 (газ) | Н2 | СО | Н2О (пар) | N2 | Воздух | ||||||||||
| Показатель коррозии * | |||||||||||||||||||
| весо-вой | глубин-ный | весо-вой | глубин-ный | весо-вой | глубин-ный | весо-вой | глубинный | весо-вой | глубин-ный | весо-вой | глубин-ный | весо-вой | глубин-ный | весо-вой | глубин-ный | весо-вой | глубин-ный | ||
| Алюминий | 1,51 4,53 | 500°С 4,876 600°С 14,63 | нестоек | Стоек.Незн-я кор-ия при 300°С | Стоек | Стоек | Незначит. кор-ия при 500°С | 0,0 | Стоек | Стоек | |||||||||
| Инконель | 1,43 | 600°С 1,52 | – | – | – | Стоек | – | – | – | Стоек | |||||||||
| Магний | 2,56 | 500°С 12,8 | Удовлетворительно стоек | Стоек | Нестоек. При 600°С становится хрупким | – | – | – | Быстро окисляется с пов-ем темп-туры | ||||||||||
| Медь | 1,52 1,52 | 500°С 1,22 600°С 1,22 | Применима в безводном HF | – | Неприм-ма.Образует ядовитые соли | Выше 400°С технич.сорта не прим-мы | Неприменима | Применима до 600°С | Применима | Образует окалину при повыш-ых темп-х | |||||||||
| Монель-металл | 1,22 1,83 | 500°С 1,22 600°С 1,98 | Стоек | Нестоек | Стоек | – | <0,1 | Хорошо стоит до 900°С | – | Стоек | |||||||||
| Никель | 500-600°С 0,91 0,91 | Стоек | Стоек | Стоек | – | Неприменим | Хорошая стойкость до 900°С | 150°С <0,1. Не применим при температуре >300°C | Стоек | ||||||||||
| Сталь углеродистая | 500-600°С Неприменима | Неприменима | 500°С неприменима | – | Выше 500°С становится хрупкой | – | Применима | Применима.При 900°С слегка разъедается | Применима | ||||||||||
| Сталь хромистая | 1,34 10,2 | 500°С 1,52 600°С 11,58 | 20°С >10,0 | >11,0 | до 100°С | < 1150°С применима | – | Применима | Хорошая стойкость до 1000°С | – | Применима | ||||||||
| Сталь хромо-никелевая | 12,1 | 600°С 13,4 | 20°С >10,0 | >11,0 | до 100°С <0,1 | Применима | – | Применима | Хорошая стойкость до 1000°С | – | Применима | ||||||||
| Чугун серый | 5,26 | 500°С 6,37 | Нестоек | Стоек | – | – | – | – | – | Стоек | |||||||||
| Чугун хромистый | 0,40 | 300°С 0,48 | – | 20°С <0,5 | – | – | – | – | – | Стоек | |||||||||
* Весовой показатель коррозии дается в г/м2·ч,глубинный – в мм/год.
3.1.2.6 Коррозионноустойчивые материалы из конструкционных
керамических соединений
В последние годы во фторидных процессах стали использоваться изделия из так называемой “конструкционной” керамики: нитрида и карбида кремния (Si3N4 и SiC) и нитрида и карбида бора (BN и B4C (или B12C3) и B13C2). Эти соединения в настоящее время применяются в основном для футеровки внутренних поверхностей реакционных аппаратов, технологических трубопроводов и запорно-регулирующей арматуры.
Нитрид кремния (Si3N4) на воздухе начинает окисляться при температуре выше 900 °С, он не взаимодействует с азотной, серной и соляной кислотами, однако при температуре более 600 °С интенсивно реагирует с фтористоводородной кислотой, а взаимодействие с безводным фтороводородом начинается при температуре выше 900 °С. Поэтому нитрид кремния в качестве конструкционного материала для процессов получения тетрафторида урана можно использовать только до температуры 900 °С, что вполне приемлемо для практических целей, т.к. температура процесса гидрофторирования не превышает 750 °С.
Карбид кремния (SiC) окисляется кислородом выше 1000 °С, он не разлагается минеральными кислотами (кроме концентрированных HF, HNO3 и H3PO4 при температуре более 500 °С) и растворами щелочей, реагирует с элементным фтором при 500 °С. Поэтому карбид кремния в технологии получения тетрафторида урана можно использовать только до 500 °С.
Нитрид бора (BN) устойчив в атмосфере кислорода до ~ 750 °С. При комнатной темепратуре BN с фтороводородом образует фторборат аммония NH4[BF4], а с элементным фтором – трифторид бора (BF3) и N2. Поэтому нитрид бора в технологии получения тетрафторида урана можно использовать только при комнатных температурах.
Карбиды бора B4C (или B12C3) и B13C2 – наиболее устойчивые соединения, окисляющиеся на воздухе при температуре выше 600 °С. Карбиды бора не растворяются в воде и минеральных кислотах. Поэтому в технологии получения тетрафторида урана их можно использовать при высоких температурах (1000 °С и выше), что открывает неограниченные возможности для этих процессов.
Таким образом изделия из конструкционной керамики являются перспективными материалами, которые могут устойчиво работать в оборудовании, предназначенном для получения тетрафторида урана как “водным”, так и “сухим” методами. Выбор конструкционных материалов для процессов, где применяют фтороводород, довольно ограничен. Это создает серьезные трудности при практическом осуществлении не только в процессе получения тетрафторида урана с помощью “сухих” методов, но и всех процессов фторидной технологии.
3.1.3 Термодинамика и кинетика фторирования тетрафторида
урана элементным фтором
До недавнего времени самым распространенным и экономичным методом производства гексафторида урана являлась высокотемпературная обработка тетрафторида урана элементным фтором. Реакция взаимодействия представляет сложный гетерогенный процесс, протекающий в несколько стадий с образованием ряда промежуточных продуктов. При комнатной температуре реакция фторирования идет очень медленно. Только выше 220 °С скорость реакции становится заметной. Стадийность процесса фторирования обусловлена образованием ряда промежуточных соединений урана: U4F17,U2F9, UF5.
Из всех существующих теорий гетерогенного реагирования наиболее общепринятой является диффузионно-кинетическая, достаточно полно разработанная для горения углерода и топлива. На основании изучения реакции горения углерода установлен ряд закономерностей, которые могут быть распространены на другие аналогичные гетерогенные процессы, в том числе и на процесс фторирования тетрафторида урана элементным фтором.
Согласно этой теории, интенсивность (скорость) суммарного процесса фторирования теоретически всегда зависит как от кинетики – скорости химического реагирования, – так и от интенсивности подвода и отвода реагирующего газа и продуктов реакции; роль этих двух резко различных по своему характеру факторов зависит от конкретных условий фторирования. Фторирование тетрафторида урана всегда протекает как на внешней, контурной, поверхности слоя тетрафторида, так и на внутренней поверхности макро- и микропор, доступных молекулам реагирующего газа; количественная роль внутреннего реагирования также определяется конкретными условиями фторирования.
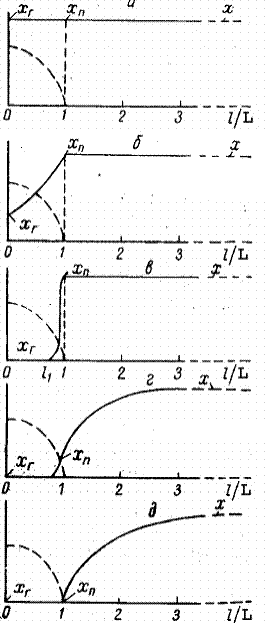
Из изложенного следует, что фторирование тетрафторида урана теоретически всегда протекает во всем объеме слоя, а интенсивность фторирования определяется скоростью переноса (диффузии) реагирующего газа и кинетикой химической реакции. Практически, однако, роль отмечаемых факторов различна, и поэтому оказалось целесообразным и удобным разделить фторирование на различные области, характеризующиеся определенным количественным влиянием различных факторов. Для характеристики физической сущности деления процесса фторирования на области и для иллюстрации практической ценности и удобства этого деления рассмотрим процесс взаимодействия слоя тетрафторида урана с потоком газа, содержащим фтор, сильно разбавленный инертным газом (рис. 1.3.20).
При низкой температуре, когда скорость химической реакции между тетрафторидом и фтором небольшая, суммарная скорость процесса с практически достаточной точностью определится скоростью химической реакции, протекающей на всей доступной для фтора поверхности макро- и микропор тетрафторида урана. В связи с малой суммарной скоростью процесса фторирования подвод фтора из газового объема к внешней поверхности слоя и даже внутрь его, в поры, обеспечивается при небольшом градиенте, так что концентрации фтора в потоке газа (х), на внешней контурной поверхности слоя (хп) и в глубине слоя (хг)можно считать практически равными: х ≈ хп ≈ хг.
В этой области, интенсивность процесса, примерно одинаковая во всем объеме слоя, с достаточной точностью определяется кинетическим уравнением химической реакции. В общем виде это уравнение имеет вид:
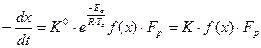 , (1.3.13)
, (1.3.13)
где К – константа скорости реакции; R – универсальная газовая постоянная; Тс – температура реагирующей поверхности; Fр – общая реакционная поверхность, пропорциональная объему слоя; f(х) – функция концентрации фтора, зависящая от механизма реакции; Еа – энергия активации гетерогенной реакции.
Область гетерогенного реагирования, для которой справедливы эти уравнения, называется чисто кинетической областью; только в ней можно экспериментально, с практически достаточной точностью исследовать кинетические характеристики химических реакций. В чисто кинетической области интенсивность реагирования при х и Тс = const пропорциональна массе реагирующего материала (при Fp ≈ Fп – реакционной поверхности пор) и не зависит от размера слоя материала и от гидродинамических условий реагирования.
Повышение температуры реагирования или увеличение толщины слоя тетрафторида урана выше некоторого предела приводит к нарушению приближенного равенства, представленного уравнением (1.3.13). В этом случае удельная скорость диффузии фтора в глубину реагирующего слоя оказывается недостаточной при небольшом перепаде концентрации для обеспечения подвода фтора, необходимого для реакции. В связи с этим концентрация фтора в глубине слоя (хг) начинает заметно снижаться; в результате создаются условия, отвечающие соотношению х ≈ хп ≠ хт. Процесс, который отвечает этому соотношению, характеризуется кинетическим режимом на контурной поверхности Fк, но усложнен процессом внутренней диффузии в поры слоя. Здесь экспериментальное исследование кинетики химического процесса в чистом виде невозможно. Область (режим) гетерогенного реагирования, подчиняющегося этому уравнению, называется первой (внутренней) переходной областью.
При достаточно большой толщине слоя, различной для разной температуры и сорта тетрафторида урана, фтор не проникает в заметных количествах вглубь слоя и концентрация его хг практически становится равной нулю. По мере дальнейшего увеличения толщины слоя тетрафторида урана глубина проникновения фтора внутрь слоя (L – l1) все меньше и меньше по сравнению с толщиной слоя L. При этих условиях уравнение, определяющее скорость взаимодействия между газом и твердой поверхностью, формально будет аналогично приведенному выше уравнению и может быть представлено в следующем виде:
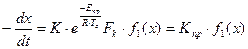 , (1.3.14)
, (1.3.14)
 l – глубина проникновения фтора; L – толщина слоя
Рис. 1.3.20 Распределение концентраций фтора внутри и вне слоя тетрафторида урана в чисто кинетической области гетерогенного реагирования (а) – хг ≈ хп ≈ х; в первой переходной области (б) – хг ≠ хп ≈ х; в кинетической области (в) – хг ≠ хп ≈ х; L – l1 < 0,3L; во второй переходной области (г) – хг ≈ 0; хп < х; в диффузионной области (д) – хг ≈ 0; хп < 0,1 х;
l – глубина проникновения фтора; L – толщина слоя
Рис. 1.3.20 Распределение концентраций фтора внутри и вне слоя тетрафторида урана в чисто кинетической области гетерогенного реагирования (а) – хг ≈ хп ≈ х; в первой переходной области (б) – хг ≠ хп ≈ х; в кинетической области (в) – хг ≠ хп ≈ х; L – l1 < 0,3L; во второй переходной области (г) – хг ≈ 0; хп < х; в диффузионной области (д) – хг ≈ 0; хп < 0,1 х;
|
где Kпр и Епр – соответственно приведенные константа и энергия активации; Fк – внешняя контурная поверхность; f1(x) – соответствующая функция концентрации реагирующего газа.
Следует отметить, что если f(х) дает слабую зависимость (ниже первого порядка) от концентрации фтора, то f1(x) в последнем уравнении для той же химической реакции будет показывать более сильное, приближающее к первому порядку влияние концентрации фтора на суммарную скорость взаимодействия. Область, соответствующую приведенному уравнению, называют кинетической областью. В ней при х = const и Тс = const интенсивность процесса не зависит от гидродинамического режима, но зависит от поверхности твердого вещества (она приближенно пропорциональна внешней, контурной поверхности слоя), а температура реакционной поверхности влияет на интенсивность процесса сильно, хотя и в меньшей степени, чем в чисто кинетической и внутренней переходной областях. Характерной особенностью кинетической области гетерогенного реагирования является наличие внутреннего реагирования (в порах) при формальной зависимости скорости процесса, характерной для чисто поверхностных реакций. Указанная особенность процесса часто приводит к неправильному выводу о наличии в этой области гетерогенного реагирования только поверхностной реакции.
При дальнейшем повышении температуры реагирования более быстрое увеличение удельной скорости химической реакции по сравнению с ростом удельной скорости подвода реагирующего газа к реакционной поверхности приводит к значительному изменению концентрационных напоров, которое начинает постепенно создавать заметную разность между концентрацией реагирующего газа в газовом объеме и на контурной поверхности слоя. В этих условиях гетерогенный процесс смещается во вторую (внешнюю) переходную область, когда
х ≠ хп; 0,9х > хп > 0,1х, (1.3.15)
т. е. концентрация реагирующего газа у внешней контурной поверхности реагирующего UF4 становится заметно меньше средней концентрации реагирующего газа в газовом объеме. С точностью порядка 10 %, представляющей практический интерес, границы второй переходной области определяются неравенством (1.3.15). Совершенно ясно, что, изменяя температуру реагирования или гидродинамический режим, например скорость обтекания реагирующего слоя тетрафторида урана газовым потоком, мы во второй переходной области будем изменять концентрационный градиент (х – хп) и, следовательно, изменять интенсивность суммарного реагирования. В этой области скорость реагирования будет сильно зависеть от интенсивности переноса и от интенсивности (кинетики) химиической реакции между тетрафторидом урана и элементным фтором.
Последняя (пятая) область гетерогенного реагирования, которая наступает при еще большем повышении температуры или соответствующем изменении гидродинамического режима реагирования, характеризуется максимальным внешним концентрационным перепадом, когда
х – хп ≈ х; 0,1х > хп > 0. (1.3.16)
В этой области скорость расходования фтора на взаимодействие с тетрафторидом урана с практически достаточной точностью определяется интенсивностью чисто физического процесса переноса реагирующего газа из газового объема к внешней, контурной поверхности тетрафторида урана и продуктов реакции. Область, характеризующуюся этим уравнением, называют диффузионной областью. Здесь интенсивность непосредственно гетерогенной реакции практически не зависит от активности реагирующей твердой поверхности. В этом смысле различие сортов тетрафторида урана (по активности, пористости и т. д.) в диффузионной области не влияет и не может влиять на интенсивность расходования фтора, и в то же время наиболее сильно сказывается на ней изменение гидродинамического режима реагирования (форма поверхности, характер и скорость течения и т. д.).
Из приведенных характеристик различных областей процесса фторирования совершенно очевидны практические преимущества такого деления, так как знание области гетерогенного реагирования позволяет заранее предопределить пути интенсификации процесса или его соответствующей организации. Так, для первой области наиболее интенсифицирующим фактором является увеличение температуры реагирования и общей массы реагирующего тетрафторида урана. Если же реакция находится в диффузионной области, то в этом случае повышение температур не имеет никакого практического значения для повышения интенсификации. В этой области наибольшую роль играют гидродинамические условия процесса (форма поверхности, характер и скорость течения и т. д.).
Для кинетической области повышение температуры будет, хотя и в меньшей степени, чем в чисто кинетической области, ускорять процесс; толщина слоя не окажет существенного влияния на интенсивность процесса образования гексафторида урана. Гидродинамический режим, в том числе и скорость потока газа, в этом случае, как и в чисто кинетической и в первой переходной областях, не будет влиять на суммарную скорость реагирования. Равномерный подвод фтора ко всей реагирующей поверхности тетрафторида урана и отвод гексафторида являются обязательными условиями, так как иначе возможен локальный переход процесса в другие области реагирования.
Для использования всех преимуществ, которые дает вышеприведенная схема гетерогенного реагирования, необходимо иметь возможность с достаточной точностью рассчитывать границы областей для тех или иных условий процесса. Количественный расчет этих границ основывается на учете химических и физических характеристик фторирования. Так, границы чисто кинетической области (у)с точностью примерно до 10 % могут быть определены из следующего соотношения (по аналогии с процессом горения углерода):
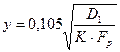 , (1.3.17)
, (1.3.17)
где D1 – коэффициент внутренней диффузии; К – константа скорости реакции; Fp – общая реакционная поверхность.
Граница между чисто кинетической и первой переходной областями для сферических частиц определяется из неравенства:
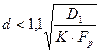 . (1.3.18)
. (1.3.18)
Граница между кинетической и первой переходной областями с точностью примерно до 10 % определяется из соотношения:
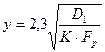 , (1.3.19)
, (1.3.19)
а для сферических частиц из неравенства:
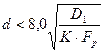 . (1.3.20)
. (1.3.20)
Большой интерес представляют количественные определения границ между кинетической и второй переходной, а также между второй переходной и диффузионной областями. В этом случае определяющим условием перехода из одной области в другую является значение критерия Семенова (Sm). Соотношение между критерием Семенова и концентрацией фтора на внешней реагирующей поверхности (хп) тетрафторида урана (по аналогии с процессом горения углерода) имеет вид:
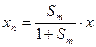 . (1.3.21)
. (1.3.21)
При значении величины критерия Sm > 9 гетерогенный процесс и, в частности, процесс фторирования тетрафторида урана фтором находятся в кинетической области. При изменении Sm в пределах от 0,11 до 9,0 процесс фторирования находится во второй переходной области. Если же величина критерия Семенова меньше 0,11, то гетерогенный процесс будет находиться в диффузионной области. В этом случае эффективность фторирования практически полностью определяется интенсивностью подвода фтора.
Для исследования процесса фторирования очень важно знать действительную величину реакционной поверхности. Однако ее определение в связи с влиянием многих факторов сопряжено с большими трудностями. Поэтому определяемую обычными способами удельную поверхность порошкообразных материалов только приближенно можно принимать за реакционную.
Изложенные положения дают возможность изучать и рассчитывать (на основании опытных данных) процесс фторирования тетрафторида урана фтором при любой температуре. Имеющиеся в настоящий момент данные позволяют охарактеризовать этот процесс только в интервале 265-350 °С (фторировали небольшие навески тетрафторида урана, в очень тонком слое большим избытком фтора, процесс протекал в чисто кинетической области). На рис. 1.3.21 приведена кривая получения гексафторида урана, построенная на основании потерь массы тетрафторида при 300 °С. Как видно из рисунка, сначала гексафторида почти не образуется; это объясняется тем, что система перед подачей фтора была заполнена азотом. В дальнейшем наблюдается почти прямолинейная зависимость, за исключением конечного участка кривой, где фторируются промежуточные фториды урана.
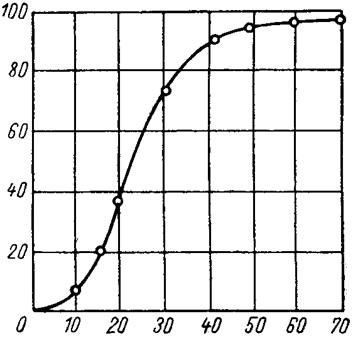 Парциальное давление фтора 220 мм рт. ст.;температура 300 °С; тетрафторид урана получен гидрофторированием диоксида урана
Рис. 1.3.21 Влияние продолжительности процесса фторирования на выход гексафторида урана
Парциальное давление фтора 220 мм рт. ст.;температура 300 °С; тетрафторид урана получен гидрофторированием диоксида урана
Рис. 1.3.21 Влияние продолжительности процесса фторирования на выход гексафторида урана
|
| Продолжительность процесса, мин |
| Выход гексафторида урана, % |
Количественные данные по взаимодействию тетрафторида урана с фтором математически обработаны в соответствии с предположением об уменьшении в результате процесса фторирования поверхности отдельной сферической частицы тетрафторида урана строго по сфере. Первоначальная масса частицы m0 определяется по уравнению:
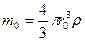 , (1.3.22)
, (1.3.22)
где r0 – первоначальный радиус частицы; ρ – плотность вещества.
Скорость уменьшения массы (скорость фторирования) определяется из уравнения:
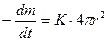 , (1.3.23)
, (1.3.23)
где r0 – радиус частицы в момент времени t; К – величина, постоянная для заданной температуры и заданного парциального давления фтора.
Относительное количество прореагировавшего вещества составит:
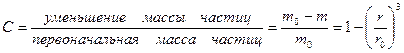 , (1.3.24)
, (1.3.24)
и далее:
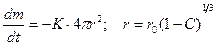 ; (1.3.25)
; (1.3.25)
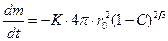 . (1.3.26)
. (1.3.26)
Скорость относительного изменения массы частиц можно получить из уравнений:
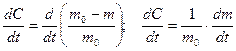 . (1.3.27)
. (1.3.27)
Из этих уравнений следует, что:
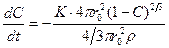 , (1.3.28)
, (1.3.28)
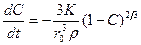 . (1.3.29)
. (1.3.29)
Интегрируя выражение, получаем:
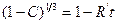 . (1.3.30)
. (1.3.30)
где R’ – постоянная величина при заданной температуре и заданном парциальном давлении фтора.
В координатах время – величина 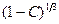 экспериментальные точки хорошо ложатся на прямую, что подтверждает соответствие предполагаемой модели процесса его действительному характеру.
экспериментальные точки хорошо ложатся на прямую, что подтверждает соответствие предполагаемой модели процесса его действительному характеру.
Отклонение от прямой линейной зависимости в системе координат время – величина 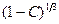 наблюдается при завершении процесса фторирования; это объясняется тем, что тетрафторид взаимодействует со фтором значительно быстрее, чем промежуточные продукты (фториды урана). Энергия активации фторирования, определенная для различных образцов тетрафторида урана, колеблется от 64,1 до 83,4 кДж/молъ.
наблюдается при завершении процесса фторирования; это объясняется тем, что тетрафторид взаимодействует со фтором значительно быстрее, чем промежуточные продукты (фториды урана). Энергия активации фторирования, определенная для различных образцов тетрафторида урана, колеблется от 64,1 до 83,4 кДж/молъ.
При взаимодействии тетрафторида урана со фтором в некоторый момент, когда реакция близка к завершению, концентрация фтора в центре частицы достигает величины концентрации на поверхности; при этом вполне возможны фазовые превращения, так как концентрация фтора повышается настолько, что частица становится одним из промежуточных фторидов урана. Скорость фторирования этих соединений, полученных из тетрафторида воздействием на него гексафторида при 300 °С и давлении 42 мм рт. ст., меньше скорости фторирования самого тетрафторида урана при тех же условиях.
В табл. 1.3.5 представлены данные по фторированию промежуточных фторидов урана и тетрафторида. Эти результаты показывают, что промежуточные фториды с составом, близким к U4F17, фторируются фтором при 300 °С до U2F9. При дальнейшем фторировании получается гексафторид урана. Скорость фторирования промежуточных фторидов меньше, чем тетрафторида урана при тех же условиях. Соотношение констант скоростей реакций равно приблизительно 1 : 4.
Таблица 1.3.5
Фторирование промежуточных фторидов урана
| Метод получения тетрафторида урана, используемого для приготовления промежуточного фторида | Состав промежуточных фторидов до обработки фтором | Температура фторирования, °С | Состав промежуточных фторидов после обработки фтором | Константа скорости реакции фторирования промежуточных фторидов урана R', мин-1 | Константа скорости фторирования, вычисленная для UF4-R’, мин–1 |
| Дегидратация кристаллогидрата UF4·2Н2О . . . . . . | UF4,52 | UF4,52 | 0,00770 | 0,0185 | |
| То же . . . . . . . . . . | UF4,28 | UF4,57 | 0,00530 | 0,0185 | |
| Гидрофторирование диоксида урана . . . . . . . . . . . . . | UF4,23 | UF4,32 | 0,00476 | 0,0212 | |
| То же . . . . . . . . . . | UF4,19 | UF4,52 | 0,00435 | 0,0196 |
В табл. 1.3.6 представлены данные по влиянию парциального давления фтора на скорость фторирования.
Таблица 1.3.6
Влияние парциального давления фтора на скорость фторирования
тетрафторида урана *
| Соотношение по объему фтора и азота | Парциальное давление фтора Р, мм рт. cm | Константа R', мин–1 | Величина отношения 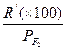
|
| ∞ 1 : 1 1 : 2,5 1 : 10 | 0,0877 0,0383 0,0245 0,0050 | 0,0115 0,0105 0,0111 0,0070 |
* Тетрафторид урана получен гидрофторированием диоксида урана при 400 °С; фторирование тетрафторида элементным фтором проводилось при 308 °С.
В исследованном интервале парциальных давлений вплоть до атмосферного скорость фторирования почти прямо пропорциональна давлению фтора.
Влияние поверхности тетрафторида урана на скорость фторирования характеризуется данными табл. 1.3.7.
В соответствии с этими данными скорость образования гексафторида урана не прямо пропорциональна величине поверхности, найденной методом адсорбции газов и включающей поверхность трещин и пор в твердом материале. Следует полагать, что величина поверхности, измеренная по реакции со фтором, не должна включать внутреннюю поверхность этих пор, в которые фтор мог бы проникнуть с большим трудом и из которых десорбция гексафторида урана была бы затруднена.
Сублимированный тетрафторид урана получается в хорошо кристаллизованном виде, тогда как дегидратированный и гидрофторированный материалы обладают очень пористой структурой. Это положение хорошо объясняет экспериментально найденные скорости реакции: пористые продукты реагируют с фтором с меньшей скоростью, чем следовало бы ожидать, исходя из величины поверхности, определенной методом адсорбции.
Таблица 1.3.7
Влияние величины удельной поверхности тетрафторида урана на скорость его фторирования*
| Способ получения тетрафторида урана | Температура получения тетрафторида, °С | Удельная поверхность исходного тетрафторида урана S, м2/г | Температура фторирования, °С | Константа R', мин–1 | Величина отношения 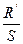 , г/м2·мин , г/м2·мин
|
| Сублимация тетрафторида урана То же . . . . . . . . . Гидрофторирование диоксида урана . . . . . . . . . . То же . . . . . . . . . . Дегидратация кристаллогидрата UF4·2,5 H2O . . . . То же . . . . . . . . . . | 0,021 0,021 0,930 0,930 2,020 2,020 | 0,0024 0,0080 0,0113 0,0290 0,0107 0,0341 | 0,1123 0,3800 0,0122 0,0312 0,0051 0,0169 |
* Фторирование проведено в токе азота; парциальное давление фтора 220 мм рт. ст.
Скорость подачи фтора не влияет на скорость образования гексафторида урана, как это и должно быть в чисто кинетической области гетерогенного реагирования (табл. 1.3.8).
Таблица 1.3.8
Влияние скорости подачи фтора на константу скорости фторирования *
| Скорость газа, см/мин | Скорость общего потока, см3/мин | R', мин–1 |
| 2,4 | 0,0227 0,0265 0,0217 |
* Температура фторирования 311 °C; парциальное давление фтора 220 мм рт. ст.; тетрафторид ураyа получен гидрофторированием диоксида.
Реакция образования гексафторида сопровождается выделением большого количества тепла. За счет выделяющегося тепла частицы твердого материала разогреваются. Разогрев частицы достигает максимального значения при протекании реакции в диффузионной области. Температура твердой частицы в этом случае равна теоретической температуре реакции, которая, в свою очередь, определяется концентрацией фтора в газовой фазе.
В статических условиях (или при недостаточной интенсивности перемешивания) и при высокой концентрации элементного фтора температура твердого материала может значительно повышаться. Так как промежуточные фториды урана, а также уранилфторид и примеси, присутствующие в исходном тетрафториде урана, обладают способностью спекаться, плохое перемешивание твердой и газовой фаз может привести к оплавлению материала и к еще большему ухудшению контакта фаз. Поэтому всегда выгоднее проводить процесс получения гексафторида урана в газовой взвеси; в этих условиях разогрев частицы незначителен, так как температура ее практически равна температуре газа. При изменении начальной температуры реагирующих веществ максимальная температура твердой частицы изменяется примерно в той же степени, т. е. величина разогрева остается приблизительно постоянной.
3.1.3.1 Режим и аппаратурное оформление производства
гексафторида урана из очищенного тетрафторида
В первые годы эксплуатации урановых заводов для производства гексафторида урана использовался периодический процесс Исходным продуктом служил тетрафторид урана, полученный также периодическим способом, – гидрофторированием диоксида урана в муфельных полочных печах.
Поступающий на фторирование тетрафторид содержит в виде примеси диоксид урана и уранилфторид. Эти соединения переводятся фтором в гексафторид урана по реакциям:
UO2 + 3F2 → UF6 + O2, (1.3.31)
UO2F2 + 2F2 → UF6 + O2. (1.3.32)
Поэтому наличие примесей, как правило, не нарушает процесс; увеличивается лишь расход фтора.
Для фторирования использовались горизонтальные трубчатые печи, в которые вставлялись никелевые лодочки с загруженным в них тетрафторидом урана.
Процесс осуществлялся при температуре 300 °С; для полного использования фтора газ пропускали последовательно через несколько реакторов. Чтобы полностью профторировать продукт в головном аппарате требовалось примерно 24-часовое пропускание элементного фтора; за это время тетрафторид превращался в гексафторид во втором аппарате на две трети, а в третьем – на одну треть. Использование элементного фтора было близко к 100 %. После каждой загрузки лодочки с продуктом продвигались в направлении, противоположном движению газа. Толщина слоя тетрафторида составляла 70 – 80 мм; большая суммарная длительность процесса была обусловлена в основном образованием в первые моменты реакции оплавленного слоя промежуточных фторидов урана, резко ухудшавшего условия фазового контакта.
Гексафторид урана конденсировали из газовой фазы после каждого аппарата фторирования; конденсаторы охлаждали водой, имеющей температуру 2 °С. Для получения кондиционного по содержанию легколетучих примесей гексафторида урана продукт очищали отгонкой примерно 10 % продукта и последующей его конденсацией. Общий выход гексафторида урана составлял 98 %.
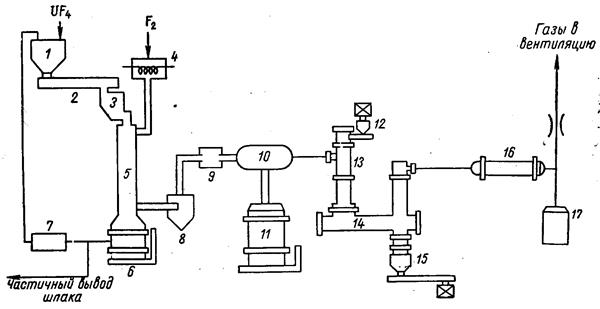 1 – бункер питания; 2 – шнек; 3 – распределитель; 4 – подогреватель фтора; 5 – пламенный реактор; 6 – шлакоприемник; 7 – измельчение шлака; 8 – циклонный сепаратор; 9 – фильтр; 10 – головной конденсатор; 11 – приемник гексафторида урана; 12 – бункер тетрафторида урана; 3 – хвостовой реактор; 14 – шнековая печь; 15 – приемник промежуточных фторидов; 16 – хвостовой конденсатор; 17 – приемник гексафторида урана
Рис. 1.3.22 Схема цепи аппаратов получения гексафторида урана из очищенного тетрафторида
1 – бункер питания; 2 – шнек; 3 – распределитель; 4 – подогреватель фтора; 5 – пламенный реактор; 6 – шлакоприемник; 7 – измельчение шлака; 8 – циклонный сепаратор; 9 – фильтр; 10 – головной конденсатор; 11 – приемник гексафторида урана; 12 – бункер тетрафторида урана; 3 – хвостовой реактор; 14 – шнековая печь; 15 – приемник промежуточных фторидов; 16 – хвостовой конденсатор; 17 – приемник гексафторида урана
Рис. 1.3.22 Схема цепи аппаратов получения гексафторида урана из очищенного тетрафторида
|
В дальнейшем был разработан непрерывный высокопроизводительный процесс получения гексафторида урана из очищенного тетрафторида, простейшая схема которого приведена на рис. 1.3.22.
Тетрафторид урана из бункера 1 шнеком 2 через распределитель 3 подается в пламенный реактор 4. Туда же через подогреватель 4 поступает и предварительно подогретый элементный фтор. Для количественного фторирования тетрафторида урана необходим 10 % мас. избыток элементного фтора. Непрореагировавший твердый продукт в количестве, не превышающем 0,5 % мас. от исходного тетрафторида урана, ссыпается в шлакоприемник 6 и после измельчения в мельнице 7 вновь направляется в пламенный реактор 5. Отходящие из пламенного реактора газы проходят циклонный сепаратор 8, пористый керамический фильтр 9 и направляются в головной конденсатор 10 для десублимации полученного гексафторида урана из газового потока. Выделенный гексафторид урана собирается в приемнике 11. Несконденсированный элементный фтор используется в реакторе улавливания избытка фтора 13, где фторируется тетрафторид урана в основном до промежуточных фторидов – UF5, U2F9, U4F17. Для выгрузки твердого продукта из реактора 13 в бункер 15 предназначена шнековая печь 14. Частично профторированный материал из реактора улавливания избытка фтора 13 направляется в пламенный реактор 5, а отходящие газы, содержащие незначительное количество гексафторида урана, поступают в хвостовой конденсатор 16. Неконденсируемые газы, очищенные от фтора и гексафторида урана, направляются в вентиляцию. Процесс полностью автоматизирован и контролируется с центрального пульта. Суммарный выход гескафторида урана составляет около 99,99 %; использование фтора – не менее 99,9 %.
3.1.3.2 Фторирование очищенного тетрафторида урана
в пламенных реакторах
Наиболее широкое применение для производства гексафторида урана получил высокопроизводительный реактор фторирования в пламени(пламенный реактор). Общий вид пламенного реактора изображен на рис. 1.3.23, а его схема показана на рис 1.3.24.
Наиболее широкое применение в производстве гексафторида урана получил высокопризводительный пламенный или факельный реактор. На зарубежных заводах используют пламенные реакторы диаметром 101,6; 152,4; 203,2 и 300 мм, длиной 3000 мм. Их производительность достигает соответственно 2; 5; 7,5 и 10 т урана в сутки. В России применяют пламенные реакторы диаметром 400 мм, высотой 6000 мм, производительность которых достигает 15, 0 т урана в сутки. Аппараты пламенного типа применяются для переработки как очищенного тетрафторида урана, так и для фторирования сырого (неочищенного) тетрафторида урана, например полученного из урановых концентратов. Несмотря на то, что в таком материале могут присутствовать легкоплавкие примеси, например натрий, пламенный реактор может с успехом использоваться для фторирования тетрафторида урана.
Тонкоизмельченный тетрафторид урана из контейнера 1 (рис 1.3.24) объемом 500 л поступает в загрузочный бункер 2 из которого шнеком с помощью электропривода подается в аппарат реакционны
Дата добавления: 2019-05-21; просмотров: 1011;











