Применение краун-эфиров
Применение краун-эфиров определяется, прежде всего, их избирательной способностью захватывать катионы определенного размера. Наибольшее распространение получили краун-эфиры, содержащие только гетероатомы О. Их применяют в технологических процессах, связанных с выделением и очисткой солей щелочных и щелочноземельных металлов, в аналитических исследованиях и работах, связанных с синтезом, когда нужно перевести неорганические соединения из водной фазы в органическую среду.
Краун-эфиры обладают противомикробной и противопаразитарной активностью, кроме того, из организма с их помощью выводятся ионы токсичных тяжелых металлов, а также радиоактивных изотопов цезия и стронция.
В радиохимии краун-эфиры помогают решать проблему переработки отходов ядерных производств. Первый этап - удаление с помощью краун-эфиров из переработанного ядерного горючего наиболее активных изотопов (стронций-90, цезий-137, технеций-99), на этой стадии предпочтительны S-содержащие краун-эфиры, поскольку они обладают повышенной радиационной стойкостью. Извлеченные изотопы используются затем в установках радиодиагностики, заменяющих рентгеновские аппараты, а также при создании долговременных источников тока для метеостанций, метеозондов и космических аппаратов. Следующий этап переработки ядерного топлива - извлечение с помощью краун-эфиров (специально подобранного состава) неизрасходованных урана и плутония, после чего объем подлежащих утилизации отходов становятся заметно меньше и к тому же отходы обладают слабой радиоактивностью.
На основе краун-эфиров созданы электропроводящие материалы нового типа.
II. Криптанды
Криптанды – семейство макрогетероциклических соединений, состоящих из двух и более циклов и являющиеся полидентатными лигандами в комплексах с катионами металлов. Впервые криптанды были изучены французским химиком Ж. М. Леном в 1969 г.
В криптандах узловыми атомами (общими атомами для всех макроциклов) могут быть углерод или азот, атомами в составе циклов — кислород, сера или азот.
Свойства
Криптанды представляют собой жидкие или кристаллические вещества, растворимые как в воде, так и в органических растворителях. С ионами металлов, главным образом, щелочных и щелочноземельных, криптанды образуют очень прочные комплексы криптаты, в которых ион металла прочно экранируется окружающими атомами от молекул растворителя и противоионов, причём эти комплексы тем устойчивее, чем ближе размеры внутренней трёхмерной полости к размерам катиона.
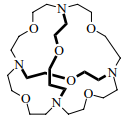
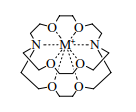 Внутренняя полость криптандов защищена с трех сторон атомами кислорода, соединенными между собой и с мостиковыми азотами группами CH2CH2 . Больше других изучен криптанд [2.2.2]криптанд [1]. Его полость хорошо подходит для размещения небольших катионов, в том числе протона, ионов Na+ и K+. Они удерживаются внутри как стенками, то есть пространственно, так и электростатическим притяжением электронных пар шести атомов кислорода и двух атомов азота. Прочность соответствующих комплексов на 4–5 порядков выше, чем у комплексов краун-эфиров.
Внутренняя полость криптандов защищена с трех сторон атомами кислорода, соединенными между собой и с мостиковыми азотами группами CH2CH2 . Больше других изучен криптанд [2.2.2]криптанд [1]. Его полость хорошо подходит для размещения небольших катионов, в том числе протона, ионов Na+ и K+. Они удерживаются внутри как стенками, то есть пространственно, так и электростатическим притяжением электронных пар шести атомов кислорода и двух атомов азота. Прочность соответствующих комплексов на 4–5 порядков выше, чем у комплексов краун-эфиров.
Другой разновидностью криптандов является соединение [2], напоминающее по форме мяч. Объем его полости лучше всего приспособлен для размещения ионов Cs+ и NH4+. И действительно, соответствующий цезиевый комплекс – самый устойчивый из всех известных комплексов этого катиона.
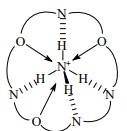 Прочность комплекса [3] возрастает за счет того, что водородные атомы тетраэдрического иона направлены в сторону атомов азота криптанда, образуя с ними водородные связи.
Прочность комплекса [3] возрастает за счет того, что водородные атомы тетраэдрического иона направлены в сторону атомов азота криптанда, образуя с ними водородные связи.
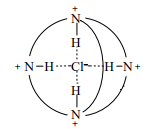 Криптанды можно приспособить и для комплексации анионов, если окружить полость положительно заряженными центрами. Например, внутрь протонированного криптанда [2] хорошо входит анион хлора, образуя комплекс [4], где хлор удерживается и водородными связями, и электростатически. Поскольку бромид-анион размещается в той же полости с трудом, соединение [4] – подходящий реагент для разделения анионов Cl− и Br− .
Криптанды можно приспособить и для комплексации анионов, если окружить полость положительно заряженными центрами. Например, внутрь протонированного криптанда [2] хорошо входит анион хлора, образуя комплекс [4], где хлор удерживается и водородными связями, и электростатически. Поскольку бромид-анион размещается в той же полости с трудом, соединение [4] – подходящий реагент для разделения анионов Cl− и Br− .
Синтез
Криптанады с узловыми атомами N получают ацилированием азакраун-эфиров хлорангидридами дикарбоновых кислот в условиях большого разбавления с последующим восстановлением образующихся бициклических диамидов.
Аналогично получают три- и тетрациклические криптанады из би- или трициклических азакраун-эфиров. Криптанады с узловыми атомами С обычно синтезируют алкилированием гидроксиалкилкраун-эфиров дитозилатами полиэтиленгликолей в присутствии оснований.
Применение
Криптанды - катализаторы и модификаторы различных химических реакций в органическом синтезе, высокоселективные сорбенты, экстрагенты для металлов, мембраноактивные соединения в ионоселективных электродах. Способность криптанд и краун-эфиров реализовывать комплексные взаимодействия типа «гость - хозяин» используется при изучении ассоциации химических структур за счёт невалентных взаимодействий - водородной, гипервалентной и топологической связи, электростатического и гидрофобного взаимодействия.
III. Cферанды
Дональд Джеймс Крам обратил внимание на существенный недостаток краун-эфиров и криптандов. Они недостаточно хорошо организованы для приема гостевых ионов: их структура как бы сморщена, не расправлена. Поэтому при вхождении катиона внутрь полости необходима затрата дополнительной энергии на ее выравнивание, организацию, а это сказывается на устойчивости комплекса. Д. Крам решил сконструировать молекулы-контейнеры, лишенные этого недостатка, то есть с заранее предорганизованной структурой. В результате сложных многостадийных синтезов были получены так называемые сферанды – ароматические простые эфиры.
Сферанды - своего рода молекулярные чаши, стенки которых выложены ароматическими ядрами, а углубления, куда попадает частица-гость, - кислородными атомами. У этих чаш имеются даже ножки - метильные группы, связанные с фенилами. Стратегия Д. Крама полностью себя оправдала. Сферанд (12), например, образует комплекс с катионом Na+, для которого log KS = 14,1, то есть он намного устойчивее аналогичных комплексов 18-краун-6 или [2.2.2]криптанда. Но самым замечательным свойством соединения (12) является его беспрецедентная селективность Na+ / K+, составляющая 1010 и превосходящая селективность всех синтетических и природных ионофоров. Следует заметить, что, попадая внутрь сферандов, ионы щелочных металлов сильно экранируются метилами метоксильных групп. Они почти полностью защищают катион от сольватации, и последний находится как бы в вакууме.
IV. Клатраты
Клатраты (соединения включения) — образуются путём включения молекул вещества — «гостя», в полости кристаллической решетки, составленной из молекул другого типа — «хозяев» (решётчатые клатраты), либо в полость одной большой молекулы-хозяина (молекулярные клатраты).
По форме полости-клатраты классифицируются на криптато-клатраты - полость в форме клетки (krupton - скрытность), тубулато-клатраты - канальная полость (tubus - трубка), интеркалато-клатраты - слоистые соединения включения.
В любых клатратах между «хозяевами» и «гостями» образуются слабые межмолекулярные связи — ван-дер-ваальсовы или водородные. Клатраты — нестехиометрические соединения, в которых соотношение между числом молекул «гостя» и «хозяина» не обязательно целое.
Клатраты подразделяют на два больших класса в зависимости от свойств соединения-хозяина. Молекулярные клатраты образуются «хозяевами», имеющими внутримолекулярные полости; такие клатраты могут существовать как в растворе, так и в кристаллическом состоянии. Если «хозяин» способен образовывать только межмолекулярные или кристаллические полости, то из него получаются решетчатые клатраты – они устойчивы лишь в твердом состоянии.
Среди решётчатых клатратов в зависимости от формы полости различают:
· клеточные (криптатоклатраты), например клатраты гидрохинона ;
· газовые гидраты;
· канальные (тубулатоклатраты), например, клатраты мочевины, тиомочевины;
· слоистые (интеркалаты), например соединения графита ;
· кристаллоструктурные, например интерметаллиды.
Молекулярные клатраты подразделяют на:
· кавитаты, имеющие полость в виде канала или клетки, например соединения циклодекстрина или амилозы с иодом (I2);
· адикулаты, у которых полость напоминает корзину.
Решетчатые клатраты-клатраты, в которых хозяйский каркас построен из молекул, связанных друг с другом относительно слабой специфической связью (чаще других водородной). Молекула гостя в полостях такого каркаса окружена несколькими молекулами хозяина. При растворении или плавлении клатратное соединение этого типа разлагается. Термодинамическая стабильность обеспечивается благоприятным расположением молекул в полостях каркаса, вследствие чего слабые межмолекулярные взаимодействия приводят к выигрышу энергии в 20-50 кДж/моль при образовании клатратов по сравнению с энергией компонентов в свободном состоянии.
Хозяин мономолекулярных клатратов состоит из достаточно крупных молекул, каждая из которых имеет одну или более полостей, в которых могут располагаться молекулы-гости. Особенностью мономолекулярных клатратов является то, что они могут существовать и в жидкой фазе. Типичным примером может служить хорошо известное химикам синее соединение иода с амилозой крахмала. "Синюю реакцию" иод дает с веществами, которые способны образовывать канал подходящего размера, стабилизирующий полииодидную молекулу. Например, широко используемое для дезинфекции горла интенсивно синего цвета лекарство иодинол представляет собой мономолекулярный клатрат иода с поливиниловым спиртом.
Дата добавления: 2020-12-11; просмотров: 782;











