Основы термодинамики, теплотехники и рабочие процессы ГТУ. Циклы ГТУ в координатах Р-V, T-S диаграммах
Термодинамика – одна из областей физики – наука о закономерностях превращения одних видов энергии в другие (причем любых видов энергии, а не только тепловой). Для обеспечения непрерывной работы ГТУ её процессы должны идти по кругу. В термодинамике круговые процессы называются циклами. Таким образом, термодинамической базой тепловых машин является термодинамический цикл.
Термодинамический цикл ГТУ – совокупность процессов расширения и сжатия с подводом и отводом тепла, в результате которого получается полезная работа, а рабочее тело возвращается в исходное состояние.
Первым проанализировал термодинамический цикл французский инженер С. Карно в 1924 году. Это был цикл для идеального газа. Такое понятие было введено для упрощения изучаемых свойств рабочих тел.
Идеальный газ – совокупность молекул, обладающих исчезающе малыми объемами и лишенных сил взаимодействия (взаимного притяжения и отталкивания).
Именно из этого цикла была выведена зависимость к.п.д. только от температуры (теплоты) и ни от чего больше.
Исходными аксиомами термодинамики служат так называемые «начала».
Первое начало термодинамики (по существу является законом сохранения энергии) – количество теплоты, сообщенное термодинамической системе, идет на увеличение внутренней энергии системы и на совершение системой работы:
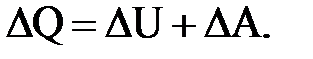
Второе начало термодинамики (лежит в основе устройства тепловых машин) – невозможно получить от двигателя непрерывную работу без отдачи теплоприемнику (в нашем случае окружающей среде) части тепла подводимого к рабочему телу, то есть невозможно всю подведенную теплоту превратить в работу.
Таким образом, к.п.д. любой тепловой машины всегда меньше единицы.
Пути увеличения к.п.д.:
- увеличение степени сжатия;
- увеличение T1(Q1) (ограничение по жаропрочности материалов);
- уменьшение T2(Q2) (применение систем регенерации тепла) – система утилизации тепла.
Состояние термодинамической системы описывается параметрами ее состояния.
Параметры состояния – физические величины, характеризующие состояние системы и поддающиеся непосредственному измерению. Для газа параметрами состояния являются: температура, давление, плотность.
1. Температура – мера нагретости вещества (тела). На практике используются две температурные шкалы – Цельсия и Кельвина:
Т (К) = t 0C + 273, 15 K.
2. Давление – это сила, действующая на единицу поверхности:
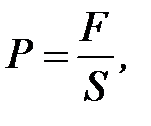 Н/м или Па.
Н/м или Па.
1 Па – давление, вызванное силой 1 Ньютон, распределенной по нормали к поверхности площадью 1 м2;
1 атм = 101325,1 Па = 1,033228 кгс/см2 = 760 мм рт. ст.;
1 бар = 100000 Па = 1,0197 кгс/см2 = 750 мм. рт. ст.;
3. Плотность – масса единицы объема – отношение массы газа к занимаемому объему:
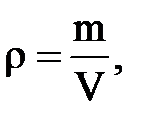 кг/м3 или г/см3.
кг/м3 или г/см3.
Величина, обратная плотности – удельный объем – объем единицы газа.
4. Удельная теплоемкость газа (с) – количество теплоты, которое нужно сообщить количественной единице газа (/м3, /кг) при нагревании его на 10.
Теплоемкость газов зависит от условий протекания процесса.
– ср – удельная изобарная теплоемкость при Р = const;
– сν – удельная изохорная теплоемкость при V = const, причем ср > сν.
Термодинамический процесс – изменение состояния термодинамической системы, то есть ее параметров состояния, зависимость между которыми определяется уравнением состояния.
Экспериментальным путем установлено, что поведение реальных газов при сжатии, нагревании и других процессах подчиняется простым законам, а именно:
- при T = const PV = const (изотермический процесс) – закон Бойля-Мариотта, 1662-1679 г.
- при P = const V/T=const (изобарный процесс) – закон Гей-Люссака, 1802 г.
- при V = const P/T = const (изохорический процесс) – закон Шарля, 1787 г.
Термический процесс, при котором один из параметров состояния постоянен, называется изопроцессом.
Адиабатический процесс – процесс, при котором нет теплообмена PVk = const.
Политропный процесс – удельная теплоемкость остается постоянной PVn.
Частными случаями политропного процесса являются процессы: изобарический P(n=0), изотермический T(n = 1), адиабатический (n = k = cp/ cν), изохорный V(n =±∞).
Удельная теплоемкость С для идеального газа Rn равна
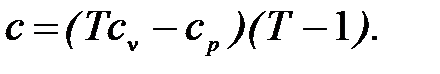
На основании сопоставления изопроцессов было выведено знаменитое уравнение состояния газа для единицы массы (уравнение Менделеева-Клайперона):
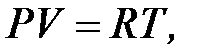
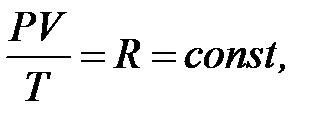
| где | R | – | газовая постоянная, 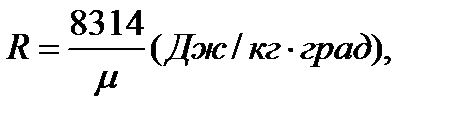
|
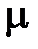
| – | молекулярный вес газа. |
Например, 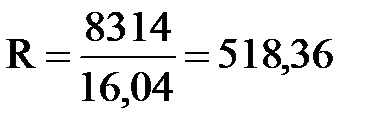 для метана.
для метана.
Реальные газы в условиях рабочих процессов ГТУ подчиняются законам идеального газа с погрешностью 2-3%.
Теплоемкость.
Теплоемкостью тела называется количество теплоты, необходимое для нагрева тела на один градус.
Теплоемкость единицы количества вещества называется удельной теплоемкостью:
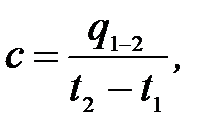
| где | t1 | – | начальная температура, |
| t2 | – | конечная температура, | |
| q1-2 | – | теплота, подведенная к единице массе. |
Энтальпия
Произведение PV можно отождествлять с работой, которую следует совершить, чтобы число некоторого объема V ввести в пространство с давлением P. Сумма внутренней энергии и потенциальной энергии давления называется энтальпией (теплосодержанием) H:.
H=U+PV,
| где | H | – | энтальпия, |
| P | – | давление, | |
| V | – | объем системы, | |
| U | – | внутренняя энергия. |
Этот параметр характеризует энергоемкость рабочего тела. Чем выше энтальпия, тем большую энергию можно получить от каждого килограмма рабочего тела, например, пара или газа.
Энтропия
Отношение количества подведенной (или отведенной) на данном участке теплоты к температуре рабочего тела 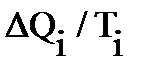 называется приведенной теплотой. Приведенная теплота считается положительной при теплоподводе и отрицательной – при теплоотводе. В курсе термодинамики доказывается, что для любого цикла сумма приведенных количеств теплоты оказывается равна 0. Это обстоятельство дает основание считать
называется приведенной теплотой. Приведенная теплота считается положительной при теплоподводе и отрицательной – при теплоотводе. В курсе термодинамики доказывается, что для любого цикла сумма приведенных количеств теплоты оказывается равна 0. Это обстоятельство дает основание считать 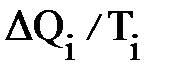 мерой изменения некоторой функции состояния и называется энтропией S:
мерой изменения некоторой функции состояния и называется энтропией S:
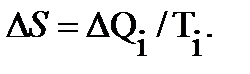
Понятие энтропии позволяет ввести чрезвычайно удобную для анализа тепловых двигателей диаграмму состояния (рис. 8), в которой по абсциссе откладывают энтропию, а по ординате – абсолютную температуру.
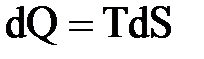
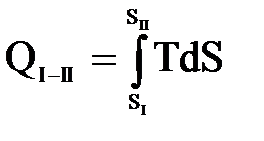
|
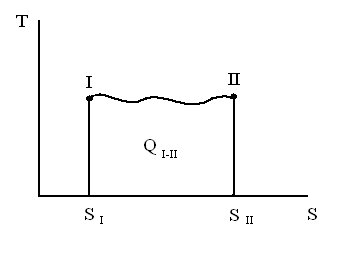
Рис. 8. График изменения энтропии и температуры рабочего тела
Энтропия зависит только от двух параметров состояния газа (T и V) и не зависит от пути перехода газа из одного состояния в другое.
Энтропию, отнесенную к 1 кг газа, называют удельной энтропией газа, обозначается через S и выражается в Дж/0К.
Каждому состоянию газа соответствуют свои параметры T, V, P (рис. 9-11).
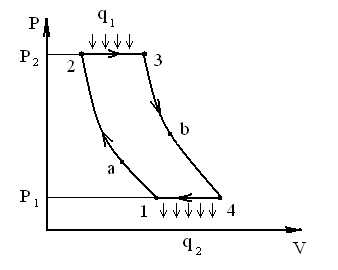
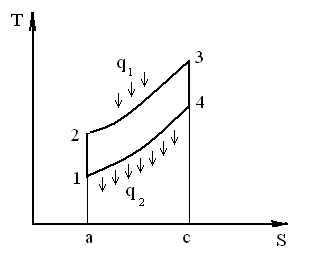
Рис. 9. Диаграммы циклов в координатах P-V и T-S
1-2 – сжатие воздуха от Р1 до Р2 – адиабата;
2-3 – подвод тепла q1 при постоянном давлении (изобара);
3-4 – расширение рабочего тела (воздух + продукты сгорания)
в газовой турбине и реактивном сопле (адиабата):
от точки 3 до точки b – отдача работы в турбине,
от точки b до точки 4 – ускорение потока в сопле;
4-1 – изобара при давлении, равном атмосферному
Степень регенерации σ – отношение тепла полученного рабочим телом в регенераторе к теплу необходимому для его нагрева до температуры отработанных газов.
Точки T1 = 15 0С; T2 = 198 0С; T3= 414 0С; T4= 780 0С; T5= 507 0С.
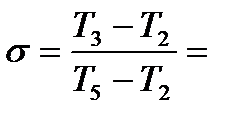
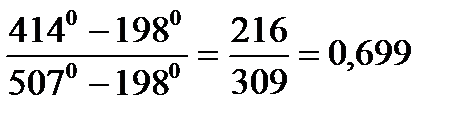 .
.
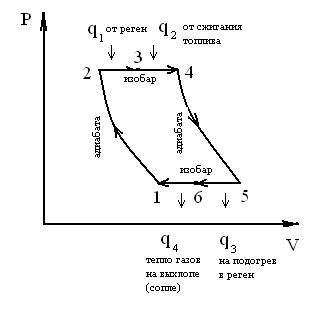
Рис. 10. Диаграмма с регенерацией тепла в координатах P-V (P=const)
1-2 – сжатие воздуха в компрессоре (изотермический или адиабатический);
2-3 – изобарный подогрев воздуха в регенераторе;
3-4 – изобарный процесс подвода тепла в КС;
4-5 – расширение газа (адиабата) в турбине;
5-6 – изобарное охлаждение выхлопных газов;
6-1 – замыкающий цикл условного изобарного процесса
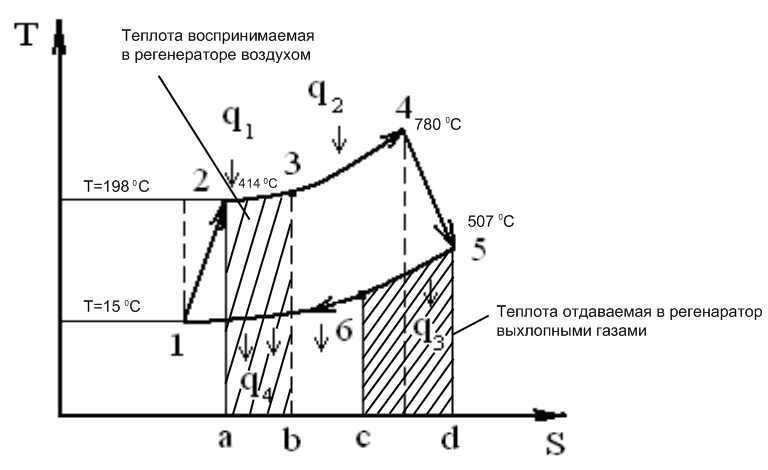
Рис. 11. Тепловая схема ГТК-10-4 в координатах T-S
Вопросы для самопроверки
1. Каковы «начала» термодинамики?
2. Что является параметрами состояния для газа?
3. Какие виды термодинамических процессов бывают?
4. Что такое энтальпия?
5. Что такое энтропия?
Осевые турбомашины
Дата добавления: 2020-12-11; просмотров: 806;











