Клиническая оценка и коррекция режима гемодинамики
Анализ гемодинамических профилей анестезий, проводимых по различным методикам, позволяет сделать следующие главные обобщения. Дляобщей анестезии типично первичное влияние на производительность сердца, тогда как тонус сосудов лишь вторично "подстраивается" под динамику сердечного выброса. При этом от выбора конкретной схемы (т.е. от сочетания препаратов) анестезии зависит скорее не наличие этого эффекта — он удивительно постоянен!, — а лишь степень его выраженности. Может быть, лишь дроперидол, неизменно снижая ОПСС, проявляет четкий индивидуальный эффект в составе комбинаций.
За введением препаратов индукции закономерно следует падение сердечного выброса с компенсаторным подъемом ОПСС. В случае, если интубируют трахею, этому конечному результату может предшествовать в разной степени выраженный кратковременный подъем СИ (постинтубационная гипердинамия), на затем непременно следует его падение. Выраженность того и другого несколько ниже при использовании схем диазепам+фентанил или этомидат+фентанил. При этом добавление фентанила способствует снижению амплитуды постинтубационного подъема СИ, на делает более выраженным его последующее снижение.
По-видимому, причина такого постоянства заключается в неизменном комбинировании препаратов, приводящем к качественному изменению эффектов. Среди них начинает преобладать то общее, что в литературе называют "снижением эфферентного симпатического потока из ЦНС", а индивидуальные гемодинамические эффекты в значительной мере нивелируются. В итоге детально описанные гемодинамические паттерны, свойственные отдельным препаратам, мало соответствуют реальной картине. Можно сказать, что описания гемодинамических эффектов отдельных препаратов соотносятся с реальностью примерно так же, как схема стадий наркоза по A.J. Guedel (1920) — с клиникой современной многокомпонентной анестезии.
Таблица 69
ИНТЕРПРЕТАЦИЯ ДИНАМИЧЕСКИХ СДВИГОВ СИ и ИОПСС
| Сердеч-ный выброс (СИ) | Тонус сосудов сопротивления (ИОПСС) | |
| Снижен | Повышен | |
| Снижен | Обычно — "избыточная" анестезиологическая агрессия: либо регионарная анестезия в условиях неадекватной компенсации МОК, либо — несколько реже — вазоплегия со снижением венозного возврата за счет относительной передозировки общих анестетиков. Еще более редкой причиной являются осложнения, напрямую не связанные с анестезией — кровотечение в условиях вазоплегии или анафилаксия на фоне кардиодепрессии | Наиболее типовой режим при стандартных схемах общей анестезии. Если СИ метаболически адекватен — это оптимум, если нет — необходима коррекция в виде снижения доз анестетиков или гипнотиков либо — при артериальной гипертензии — подключения нитропрепаратов. Может быть результатом осложнений — кардио-генной или гиповолемической ОНК |
| Повышен | "Штатная" ситуация при регионарной, вазоплегических видах общей анестезии (НЛА) или использовании вазоплегии для управления режимом кровообращения. Метаболически это малоцелесообразно, а иногда и опасно (в зависимости от динамики мощности ЛЖ) | Обычная картина ноцицептивной реакции с артериальной гипертензией. В случае неэффективности форсирования аналгезии требуется "прямая" коррекция β-блокаторами или антагонистами Ca++ |
На этапе поддержания фракционное введение препаратов общей анестезии сопровождается незначительными гемодинамическими эффектами, и общая картина определяется скорее этапом вмешательства, нежели выбором и дозировками препаратов. Как и следовало ожидать, постоянная объемно-дозированная инфузия препаратов вообще приводит к полному исчезновению каких-либо статистически значимых гемодинамических эффектов: лишь изменение темпа инфузии аналгетика ведет (не всегда!) к изменению значений отдельных переменных, на никогда — к радикальной смене картины (направленность отклонений СИ и ОПСС по отношению к исходным величинам).
Все многообразие гемодинамических ситуаций, возникающих на этапах поддержания анестезии, может быть в первом приближении описано своего рода "четырехпольной таблицей" состояний двух главных переменных — производительности сердца и тонуса резистивных сосудов (табл. 69). Эта таблица может быть предложена как более современная альтернатива аналогично построенной таблице АД/ЧСС.
Этап выхода из анестезии практически всегда сопровождается гиперкинетической реакцией кровообращения; исключение составляют крайне тяжелые (ASA IV-V) пациенты с заведомой невозможностью полноценного восстановления сознания и самостоятельного дыхания. Можно даже сказать, что развитие гиперкинетической реакции является своего рода предиктором качества посленаркозного восстановления.
Прирегионарной анестезии начало действия блока всегда отмечается падением ОПСС. Эффект настолько постоянен, что может использоваться для контроля эффективности выполненной блокады. Сердечный выброс у разных больных ведет себя по-разному. Компенсированная ситуация характеризуется его увеличением, достаточным для поддержания системного АД на приемлемом уровне. Случаи же гипотензии объясняются именно неспособностью эффективно поднять выброс.
Повторные введения анестетика при эпидуральной анестезии вызывают несколько менее выраженную гемодинамическую реакцию. Зависимость гемодинамики от этапа операции выражена слабо (тем слабее, чем "грубее" протекает анестезия, т.е. чем глубже ее собственный гемодинамический эффект).
Говоря о качестве ноцицептивной защиты, создаваемой регионарной анестезией, в частности, центральными блоками, нельзя не обратить внимание на важный, на обычно не учитываемый факт. Блокируя чувствительную иннервацию, например, высоким эпидуральным блоком, мы в то же время оставляем интактными как центростремительные, так и центробежные волокна блуждающего нерва, доходящие, как известно, до органов брюшной полости. Таким образом, высокие центральные блоки, прерывая симпатический поток в зону хирургической агрессии и в то же время оставляя нетронутыми афференты и эфференты вагуса, сдвигают соотношение регуляторных влияний в пользу "демобилизующего", антиадаптивного влияния парасимпатикуса. Таким образом, высокий центральный блок нельзя рассматривать как "абсолютный ноцицептивный блок". (Данный тезис не следует, однако, рассматривать как призыв дополнять высокую эпидуральную или спинальную анестезию шейной вагосимпатической блокадой.) Седация на фоне регионарного блока или сочетание последнего с так называемой "облегченной" общей анестезией приводит к своего рода гибридизации гемодинамических эффектов. После начала действия спинальной или эпидуральной блокады происходят обычные для такой ситуации падение ОПСС с параллельным компенсаторным подъемом СИ. на после "комбинирования" ситуация кардинально меняется: не только полномасштабная индукция, на и простая седация (субгипнотические дозы) приводит к снижению СИ, сопровождающемуся небольшим подъемом ОПСС. Далее естественно следует форсирование инфузии, а в ряде случаев и использование вазопрессоров. Этап поддержания анестезии в большей степени сходен с чистой регионарной, нежели с общей анестезией, однако реакции на повторные введения препарата в виде падения ОПСС нередко выражены сильнее, чем в случае "чистого" эпидурального блока. Гемодинамическая реакция на прекращение общей анестезии проявляется существенно слабее, чем при наркозе как таковом.
Таким образом, влияние на гемодинамику собственно анестезии зависит скорее от выбора между общей или регионарной методикой, нежели от конкретного набора препаратов.
Обсуждая и сравнивая различные эффекты, нельзя не остановиться на блоке спорных вопросов, связанных с влиянием вазодилатации и компенсаторной гипердинамии на условия работы сердца, в особенности при наличии его сопутствующей патологии. Главный момент, порождающий неясности и разночтения, берет начало с классической работы S.J. Sarnoff и соавт. (1958, [1320]). Именно эти авторы, основываясь на экспериментальных данных, впервые постулировали слабую зависимость MVO2 от величины производительности сердца и, напротив, ее тесную корреляцию с ЧСС и уровнем артериального давления. Предложенный ими индекс "напряжение-время" (Tension-Time Index — TTI) стал эталонным критерием кислородного запроса миокарда левого желудочка, надолго превратив недопущение гипертензии и тахикардии в основную задачу анестезии у больного с сердечно-сосудистой патологией. Такое осознание приоритетов породило и систему предпочтений, в которой оптимальными являются препараты и методики анестезии, в наибольшей степени блокирующие симпато-адреналовые ноцицептивные реакции [2, 924]. В результате создалась ситуация, отражаемая лозунгом: "Анестезия ради гемодинамики!": гемодинамические показатели, и прежде всего АД как наиболее доступный из них, стали критерием не только принятия тактических решений, на и оценки адекватности анестезии в целом. В то же время на современном этапе высокоселективные препараты и методики создают возможностьраздельного и взаимно-независимого управления уровнем основных компонентов анестезии и гемодинамическими параметрами. Выгоды такого подхода очевидны; по существу он вполне аналогичен происшедшему несколько десятилетий назад разделению каналов управления гипнозом, аналгезией и миорелаксацией, до того времени сосредоточенных в едином понятии "глубина наркоза" [1550]. Прежде всего, разделение каналов управления позволяет независимо соблюдать приоритеты и требования, предъявляемые клинической ситуацией к каждому из управляемых компонентов. При этом независимая регулировка доз, как это наглядно продемонстрировала концепция многокомпонентной анестезии, приводит еще и к ослаблению суммарной фармакологической агрессии. Такой анализ переводит вопрос о режиме кровообращения во время анестезии в несколько иную плоскость. В современной интенсивной терапии хорошо отработаны методы быстрого и избирательного управления всеми главными параметрами гемодинамики. Использование этих методов предоставляет возможность во время операции оптимизировать режим кровообращения в значительной мере независимо от используемых методик анестезии и текущего уровня ее отдельных компонентов. При этом постепенно формируется понимание того факта, что гемодинамически оптимальная анестезия — не та, котораявыгодно влияет на кровообращение, а та, котораяне влияет на него вовсе. В результате поддержание оптимальных уровней АД, ЧСС, производительности сердца и т.п. превращается из задачи выбора методики анестезии, обещающей удачное соотношение этих параметров, в задачу осознанного прямого управления ими.
По-видимому, при этих оговорках градация желательности кардиотропных эффектов препаратов, применяемых для анестезии, должна сегодня выглядеть следующим образом:
Нулевой > Кардиодепрессивный > Кардиостимулирующий
Под "депрессией" и "стимуляцией" выше понимаются прежде всего инотропные, а во вторую очередь — хронотропные эффекты. Дромо- и батмотропные влияния имеют к гемодинамике отношение, опосредованное главным образом гемодинамически значимыми расстройствами сердечного ритма, а люзитропный эффект, принципиально важный для осуществления насосной функции сердца, находится пока в стадии изучения. Прокомментируем приведенную выше градацию предпочтений. Наиболее очевидна ситуация с кардиостимулирующим эффектом — его реализация влечет за собой рост потребления кислорода миокардом и, соответственно, повышает риск ишемии. Выбор между нулевым (отсутствующим) и негативным инотропным эффектами объясняется упомянутой выше общей эволюционной тенденцией к повышению избирательности применяемых средств и методик. Преимущества же кардиодепрессивного эффекта перед кардиостимулирующим очевидны с позиций кардиологии: по существу, почти вся современная фармакотерапия ИБС построена на кардиодепрессивных эффектах.
Энергосберегающий подход может быть приложен и к управлению сердечным выбросом через величины пред- и постнагрузки. Поскольку уровень среднего АД диктуется "вилкой" требований перфузионной достаточности и энергорасхода миокарда, его оптимальное значение (с допуском± 10...15 мм рт.ст.) может быть выбрано заранее. Выдерживание этого оптимального уровня и означает, что управление гемодинамикой осуществляется по закону АД=const. Технически это сегодня не только не составляет проблемы, на и может быть осуществлено с помощью раздельной подстройки МОК и ОПСС. При таком условии дальнейшая оптимизация уже выходит за рамки подхода SJ. Sarnoff и соавт.
Для иллюстрации этого факта проанализируем динамику кровообращения в результате маневра его параметрами при условии АД=const. Если исходный режим характеризуется величинами МОК Qi ОПССi R и среднего АД Рi то Рi и мощность левого желудочка Ni могут быть выражены, пренебрегая величинами ЦВД и КДДПЖ, как

Пусть некое возмущение привело к снижению ОПСС до величины R такой, что R2=kRi, где k< 1. Тогда из условия выдерживания P2=Pi =const следует, что
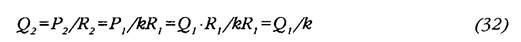
Поскольку к< 1, то из (32) следует, что необходимое для поддержания постоя нства АД Q больше Q, во столько же раз, во сколько снизилось ОПСС. Запишем теперь выражение для новой мощности ЛЖ с учетом (30) и (31):
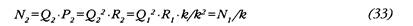
Таким образом, при условии выдерживания заданной величины АД расход мощности левым желудочком нарастает обратно пропорционально падению ОПСС. Это можно наглядно представить на диаграмме (рис. 43) в виде вектора OВ, отражающего пример вышеописанного маневра. Обширная же зона OCD представляет геометрическое место точек, соответствующих таким переходным процессам, при которых расход мощности ЛЖ растет даже несмотря на снижение САД.
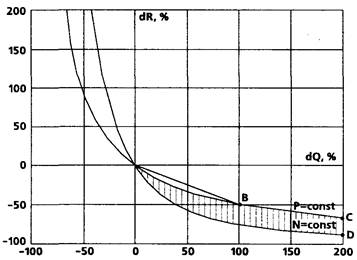
Рисунок 43.
Следовательно, оптимизация АД за счет снижения ОПСС представляется энергетически менее выгодной для миокарда, нежели уменьшение (в разумных пределах) сердечного выброса. Поскольку мощность ЛЖ пропорциональна квадрату МОК и первой степени ОПСС, "вазоплегические" методики анестезии с компенсацией АД сердечным выбросом также представляются энергетически невыгодным решением.
Однако вопрос о балансе интересов миокарда и организма в общем случае требует отдельного и более тщательного рассмотрения, не ограниченного условием постоянства АД. Одним из возможных подходов является проведенный в настоящей работе анализ соотношения механической работы левого желудочка и обеспечиваемого ею потребления кислорода тканями организма. Начальный опыт работы с показателем приведенной работы левого желудочка (ПРЛЖ) продемонстрировал его неплохую информативность и наглядность. Казалось бы, формула расхода работы левого желудочка на литр потребленного кислорода может быть легко преобразована:
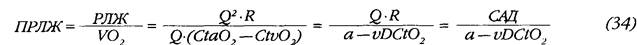
На первый взгляд, итоговая формула полностью подтверждает концепцию о ведущей роли АД как детерминанты режима кровообращения. Однако, во-первых, приведенное преобразование некорректно в силу различия между потреблением кислорода в легких и расчетной величиной, полученной по принципу Фика. С другой стороны, неочевидна функциональная зависимость между объемной артериовенозной разницей по кислороду и средним АД — а она, несомненно, имеет место хотя бы в силу влияния сосудистого тонуса на объем тканевой перфузии.
Таким образом, правомерное, на первый взгляд, преобразование (34) при более детальном анализе оказывается лишенным смысла и необходимость получения первичной информации о минутном объеме и потреблении кислорода в легких для расчета ПРЛЖ сохраняется. При этом явным преимуществом данного показателя следует считать возможность его мониторирования неинвазивным путем.
К вопросу об адекватности гемодинамического режима тесно примыкает проблема адекватности анестезии — как известно, одна из наиболее активно обсуждаемых сегодня. Разнообразие мобилизованных для ее решения подходов и методов — от наглядно-эмпирических до теории информации и системного анализа — подчеркивает глубину сложившейся неопределенности.
Накопление огромного объема данных о патофизиологии стрессового ответа привело к появлению бесчетного количества критериев оценки качества стрессовой защиты [3, 48, 61]. Гемодинамические, биохимические, эндокринно-метаболические, нейрофизиологические, иммуно-гематологичес-кие и многие другие показатели предложены сегодня для клинического внедрения [52, 72, 148, 175, 196, 447, 848, 1185, 1198, 1231, 134]]. Анализ их обоснованности и информативности выходит далеко за рамки этой работы; обратим лишь внимание на некоторые общие методологические проблемы оценки операционного стресса. С одной стороны, прямая пропорция между уровнем разнообразных, в том числе гемодинамических, маркеров стресса иклиническим результатом воспринимается как аксиома, вытекающая из результатовфундаментальных [36, 48, 61, 117, 148, 164, 196]. Между тем, например, нередкое отсутствие достоверной связи высоких уровней кортизола, АКТГ, катехоламинов, ренина, АДГ и т.д. с осложнениями и неблагоприятными исходами [1231] может быть объяснено с позиций не только вероятностной, на и вполне детерминистской логики. С точки зрения физиологии неясно, соответствует ли более высокий уровень маркеров стресса в отдельно взятом случае большему стрессу или большим реактивным возможностям. Не всегда ясно также, что означает достижение плато на кривой гормонального или гемодинамического профиля — развитие устойчивой адаптации или истощение ресурсов. Создается впечатление, что современное понимание адекватности анестезии прежде всего предполагает ее адекватность нашим физиологическим представлениям о том, какой должна быть анестезия, а уже во вторую очередь — заданному клиническому результату. Ситуация заставляет вспомнить прогноз Альберта Эйнштейна относительно главной проблемы конца двадцатого века, сделанный в 40-е гг.: 'Perfection of means, confusion of goals...' (Совершенство средств, смешение целей; цит. по [1304]).
С другой стороны, до сих пор не обоснованы количественно те пределы стресс-реакции различных систем, при которых она — в зависимости от состояния самих этих систем и целостного организма — может и должна считаться целесообразной. Представление о "стресс-норме" выглядит сегодня скорее перспективной декларацией, нежели инструментом клинического анализа. Вообще, насколько те частные критерии, которым наши сегодняшние взгляды "делегируют" полномочия представлятьвесь комплекс реакций организма, соответствуют возложенной на них глобальной функции ?
В условиях постоянного сужения функциональных противопоказаний к операциям, роста разнообразия препаратов и методик, наконец, возможностей селективного управления всеми основными гемодинамическими переменными режим кровообращения из критерия адекватности анестезии превращается в самостоятельный объект управления — как вентиляция, КОС или водно-электролитный баланс. Условно говоря, на смену старой парадигме "гемодинамика как критерий адекватности анестезии" приходит (и это четко видно по публикациям, на — к сожалению — пока только из сферы кардиоанестезиологии!) иное представление: адекватное селективное управление гемодинамикой — необходимое условие адекватности анестезиологического пособия как целого.
Между прочим, из этой позиции вытекает и иной взгляд на проблему интраоперационных вегетативных рефлексов. Концепция "нейровегетативной блокады" или "нейровегетативного торможения" [64, 66], рождение которой связано с именами Henri Laborit и Piere Huguenard [899], впервые вополощенная в методике нейролептанестезии, постепенно пересматривается. Прежде всего, становится ясной нецелесообразность полного выключения вегетативной автоматики в условиях, когда современные возможности анестезиолога не обеспечивают ни тотального контроля, ни тотальной коррекции всех быстропротекающих процессов. Даже в хорошо изученной сфере гемодинамики очевидна опасность выключения вазомоторных механизмов перед лицом, например, возможной массивной кровопотери. Изменяются приоритеты и в выборе средств борьбы с вегетативным компонентом ноцицептивной реакции. Осознаются преимущества воздействия непосредственно на уровне периферических эффекторов (например, миокарда и сосудов) не только перед влиянием на высшие вегетативные центры, защищенные гема-тоэнцефалическим барьером [886], на и перед воздействием на вегетативные ганглии. Таким образом, ненейровегетативная блокада, а целенаправленнаявегетативная коррекция становится сегодня методом выбора в борьбе с нежелательными вегетативно-рефлекторными последствиями ноцицептивного воздействия.
В контексте изучения этих наиболее общих проблем анестезиологии особую ценность представляет процедура опиоидной детоксикации под общей анестезией — уникальная модель своего рода системной (т.е. нелокализованной) ноцицептивной агрессии. Очень важно то, что ситуация в принципе исключает использование двух наиболее традиционных методик анестезиологической защиты — опиатной аналгезии и регионарных блоков. Остаются так называемые неопиатные анальгетики, инициатива использования одного из которых — аденозина — была выдвинута нами в рамках разработанной методики.
В заключение, основываясь на данных литературы и собственном опыте, попытаемся сформулировать некоторые принципы, позволяющие минимизировать возмущающее влияние анестезии на гемодинамику.
1. Главным условием является обеспечение тщательного мониторинга, иногда более важного, чем сам по себе выбор препаратов. Последний основывается навероятных в данной ситуации эффектах, тогда как первый позволяет своевременно выявлять и парировать эффектыреальные, без страха пользуясь преимуществами каждого из возможных средств. Таким образом, можно сказать, что традиционнаябезопасная активность анестезиолога уступает местоактивной безопасности больного
Широко известной иллюстрацией такой динамики подходов является отказ от тотального использования атропина в премедикации, ставший возможным и даже желательным в условиях тотального мониторинга ЭКГ.
2. Использование минимального набора препаратов узконаправленного действия: "чистый" гипнотик + "чистый" аналгетик + (при необходимости) недеполяризующий миорелаксант без ганглио- и холинолитических эффектов. По нашему опыту, наиболее отвечают этим требованиям комбинации этомидат + фентонил + ардуан или диазепам + ардуан (+ фентанил?) на фоне действия аденозина.
3. Все препараты должны вводится медленно. Это "расплывчатое" требование можно, например, трактовать так: эффект препарата по данным мониторинга должен успевать проявляться до конца его введения. Оптимальным способом введения препаратов поддержания анестезии является непрерывная инфузия с помощью дозатора [597].
4. Любые управляющие воздействия, за исключением реанимационных мероприятий, должны выполняться с интервалами. Это в особенности относится к подключению компонентов анестезии вообще и, в частности, введению препаратов индукции. Оптимальным вариантом является выполнение следующего шага после того, как гемодинамика по данным мониторинга стабилизировалась после предыдущего. Применительно к этапу выхода из анестезии это означает возможно более позднее выключение подачи гипнотиков по отношению к завершению операции и продолжение введения аналгетиков на протяжении всего этапа восстановления сознания и самостоятельного дыхания. Выполнение последнего условия становится возможным при использовании аденозиновой аналгезии.
Четвертое требование, помимо более "мягкого" управления, является обязательным еще по одной важной причине. Далеко не для всех управляющих воздействий выполняется условие аддитивности (т.е. эффект комбинации равносилен сумме эффектов компонентов), а в условиях быстропротекающих процессов зависимость эффекта от возмущения нередко становится резко нелинейной. Наиболее известным примером недоучета этого обстоятельства является авария на Чернобыльской АЭС. На ее критическом этапе резкий скачок тепловой мощности реактора был вызван, в частности, тем, что операторы вводили новые управляющие воздействия до того, как энергоблок успевал полностью отреагировать на предшествующие [170].
Качество управления гемодинамикой напрямую зависит от плавности управляющих воздействий. В особенности это относится к скорости введения препаратов, обладающих теми или иными гемодинамическими эффектами. В последние годы выделилась группа сильнодействующих препаратов с коротким периодом полувыведения, использование которых вообще возможно только с использованием точно дозирующих устройств для непрерывной инфузии. Поэтому использование дозаторов, пусть даже простейших шприцевых, представляется сегодня непременным условием качественного гемодинамического управления.
Дата добавления: 2020-11-18; просмотров: 570;











