Физическая адсорбция и хемосорбция
В зависимости от природы адсорбционных сил различают физическую адсорбцию и химическую адсорбцию, или хемосорбцию. Физическая адсорбция обусловлена действием физических, т.е. вандерваальсовых сил межмолекулярного взаимодействия. Хемосорбция обусловлена образованием химических связей между адсорбентом и адсорбатом.
Между физической адсорбцией и хемосорбцией имеется ряд существенных различий. Первое различие состоит в том, что теплоты физической адсорбции и хемосорбции сильно отличаются. Теплота физической адсорбции газов обычно равна теплоте их конденсации, а теплота хемосорбции много больше. Так, при адсорбции азота на железе  D;
D;  ;
;  .
.
Вследствие высокого значения теплоты хемосорбции процесс хемосорбции трудно обратим. Физическая же адсорбция легко обратима, процесс идет без энергии активаций и равновесие устанавливается быстро.
Необратимость хемосорбции связана также с ослаблением приповерхностных связей атомов адсорбента, вследствие чего при десорбции выделяется не адсорбат, а другое соединение. Так, при десорбции кислорода, хемосорбированного на угле, десорбируется не кислород, а оксиды углерода. Вследствие взаимодействия поверхностных атомов углерода с кислородом резко уменьшается прочность их связи с другими атомами углерода. Поэтому при десорбции отрывается оксид углерода, а не кислород.
Вещества, адсорбированные на ткани за счет физической адсорбции, могут быть легко удалены путем проветривания (нафталин, бензин и др.). Если же вещества адсорбировались за счет хемосорбции, то удалить их чрезвычайно трудно или просто невозможно. Так, анализ волос Ньютона, проведенный в 1979 году, показал повышенное содержание ртути в них. Действительно, Ньютон в течение 18 лет работа со ртутью, и это, возможно, послужило причиной его тяжелого заболевания за 33 года до смерти.
Волосы Наполеона содержали повышенное количество мышьяка, источником которого, как считают историки, послужили обои его спальни. Очевидно, мышьяк и ртуть связаны с кератином, из которого состоят волосы, химическими связями, т.е. хемосрбционно.
Второе различие между физической адсорбцией и хемосорбцией состоит в том, что физическая адсорбция может быть как монослойной, так и многослойной. Многослойная физическая адсорбция протекает при давлении насыщенного пара и переходит в конденсацию. В отличие от этого, хемосорбция всегда монослойна, при хемосорбции образуются мономолекулярные слои. При этом следует иметь в виду, что в отличие обычной химической реакции, протекающей на поверхности, когда возможны диффузия реагента вглубь объемной фазы, хемосорбция является процессом образования двумерного химического соединения, т. к. хемосорбционный слой препятствует диффузии реагента.
В качестве примера рассмотрим хемосорбцию кислорода на угле. Окисление поверхностных атомов углерода приводит к образованию различных поверхностных оксидов:

Рис. 3.4. Схема хемосорбции на угле.
Прочная пленка окисла препятствует дальнейшему проникновению кислорода вглубь твердой фазы.
Третье различие между физической адсорбцией и хемосорбцией состоит в различии кривых потенциальной энергии, вытекающем из разной природы связей, образующихся между адсорбентом и адсорбатом.
Кривые потенциальной энергии при адсорбции двухатомного газа 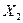 на металле
на металле  показаны на рис. 3.5.
показаны на рис. 3.5.

Рис. 3.5. Кривые потенциальной энергии для физической адсорбции (1) и хемосорбции при  (2),
(2),  (3)
(3)
Рассмотрим в качестве примера изменение потенциальной энергии молекулы газа 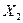 с изменением расстояния от поверхности металла, на которой она адсорбируется физически (кривая 1) и химически (кривые 2 и 3) при разной степени заполнения поверхности адсорбента
с изменением расстояния от поверхности металла, на которой она адсорбируется физически (кривая 1) и химически (кривые 2 и 3) при разной степени заполнения поверхности адсорбента 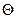 .
.
При сближении молекулы с поверхностью, потенциальная энергия уменьшается вследствие действия Ван-дер-Ваальсовых сил натяжения. По положению минимума на кривой можно определить минимальное расстояние от поверхности, а по величине этого минимуму – теплоту физической адсорбции. При дальнейшем уменьшении расстояния потенциальная энергия увеличивается вследствие проявления сил отталкивания (борновских сил). При хемосорбции молекула предварительно диссоциирует на атомы  .
.
Положение минимумов на кривых 2 и 3 соответствует оптимальному расстоянию адсорбированных атомов от поверхности, а величины этих минимумов – теплоте хемосорбции. Как видно, при хемосорбции молекула ближе подходит к поверхности , чем при физической адсорбции, а теплота хемосорбции значительно превышает теплоту физической адсорбции.
Пересечение кривой 1 с 2 и 3 отражает переход от физической адсорбции к химической. Правый и левый верхние участки кривых 2 и 3 и левый верхний участок кривой 1 не реализуется.
Результирующая кривая хемосорбции имеет максимум, образующийся при пересечении кривых 1 3 и соответствующий энергии активации адсорбции. При пересечении кривых 1 и 2 максимум отсутствует , что соответствует протеканию процесса без энергии активации.
Кривая (1) описывает изменения энергии физического взаимодействия между металлом  и газом
и газом 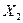 . Она включает в себя Вандер-Ваальсовы (диполь-дипольные и лондоновские) силы притяжения и борновские силы отталкивания.
. Она включает в себя Вандер-Ваальсовы (диполь-дипольные и лондоновские) силы притяжения и борновские силы отталкивания.
Кривые (2) и (3) описывают хемосорбцию, в которой молекула адсорбата в начале диссоциирует на 2 атома  . Поэтому для протекания хемосорбции необходимо затратить энергию, равную энергии диссоциации. Величина этой энергии показана на больших расстояниях от поверхности. Кривые (2) и (3) характеризуются относительно глубоким минимумом, соответствующим теплоте хемосорбции и находящемся на более близком расстоянии от твердой поверхности, чем относительно мелкий минимум на кривой физической адсорбции.
. Поэтому для протекания хемосорбции необходимо затратить энергию, равную энергии диссоциации. Величина этой энергии показана на больших расстояниях от поверхности. Кривые (2) и (3) характеризуются относительно глубоким минимумом, соответствующим теплоте хемосорбции и находящемся на более близком расстоянии от твердой поверхности, чем относительно мелкий минимум на кривой физической адсорбции.
Как правило, начальной стадией хемосорбции является физическая адсорбция. При отсутствии физической адсорбции энергия активации равна высокой энергии диссоциации молекул адсорбируемого газа. Если молекула газа вначале физически адсорбируется, то она приближается к поверхности по пути с низкой затратой энергии.
Эти кривые объясняют наблюдающуюся обычно быструю сорбцию в начале процесса и медленную в дальнейшей стадии. Кривая (2) отвечает хемосорбции, идущей для первых порций адсорбата с выделением значительной энергии (  ), уменьшающейся по мере заполнения поверхностного слоя (кривая (3) для
), уменьшающейся по мере заполнения поверхностного слоя (кривая (3) для  ). При приближении молекулы к поверхности в области больших расстояний процесс идет по кривой (1) (скорость велика,
). При приближении молекулы к поверхности в области больших расстояний процесс идет по кривой (1) (скорость велика, 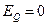 ), и переход на кривую (2) происходит без барьера. В дальнейшем, при значительной степени заполнения поверхности, для перехода от кривой (1) к кривой (3) требуется преодолеть активационный барьер, равный энергии активации хемосорбции. Такая хемосорбция называется активированной. Величина энергии активации зависит от формы кривых физической адсорбции и хемосорбции и сильно отличается для разных систем. Она является очень низкой для хемосорбции водорода на металлических поверхностях. Энергия активации входит в выражение для скорости хемосорбции типа уравнения Аррениуса:
), и переход на кривую (2) происходит без барьера. В дальнейшем, при значительной степени заполнения поверхности, для перехода от кривой (1) к кривой (3) требуется преодолеть активационный барьер, равный энергии активации хемосорбции. Такая хемосорбция называется активированной. Величина энергии активации зависит от формы кривых физической адсорбции и хемосорбции и сильно отличается для разных систем. Она является очень низкой для хемосорбции водорода на металлических поверхностях. Энергия активации входит в выражение для скорости хемосорбции типа уравнения Аррениуса: 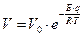 .
.
Если энергия активации хемосорбции велика, то скорость хемосорбции при низкой температуре настолько мала, что протекает только физическая адсорбция.
На рис. 3.6 показано изменение степени адсорбции газа на твердой поверхности в зависимости от изменения температуры при постоянном давлении (изобара адсорбции).

Рис. 3.6. Изобары физической адсорбции ( 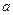 ) и хемосорбции (
) и хемосорбции ( 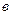 )
)
При низкой температуре протекает только физическая адсорбция, а хемосорбция не протекает. При высокой температуре протекает хемосорбция, а физическая адсорбция пренебрежимо мала.
Кривая ( 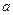 ) соответствует равновесной физической адсорбции, (
) соответствует равновесной физической адсорбции, ( 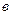 ) - хемосорбции. На обоих этих участках адсорбция обратима и равновесна. На участке (
) - хемосорбции. На обоих этих участках адсорбция обратима и равновесна. На участке ( 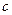 ) протекают оба процесса: физическая адсорбция и хемосорбция. Для хемосорбции на этом участке значения равновесной адсорбции велики, но скорость установления равновесия мала.
) протекают оба процесса: физическая адсорбция и хемосорбция. Для хемосорбции на этом участке значения равновесной адсорбции велики, но скорость установления равновесия мала.
Степень равновесной адсорбции при температуре, при которой скорость хемосорбции низка, но не пренебрежимо мала, представлена неравновесной кривой ( 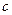 ), расположение которой зависит от времени, необходимого для достижения равновесия.
), расположение которой зависит от времени, необходимого для достижения равновесия.
Четвертое отличие физической адсорбции от хемосорбции состоит в том, что физическая адсорбция неспецифична, а хемосорбция специфична. Не специфичность физической адсорбции означает, что данное вещество примерно одинаково адсорбируется на разных адсорбентах. Это проявляется в том, что теплоты физической адсорбции данного газа на различных адсорбентах одинаковы. совпадают и изотермы адсорбции одного газа на разных адсорбентах. В качестве примера на рис. 3.7 приведена изотерма адсорбции азота на 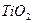 и
и 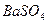 .
.
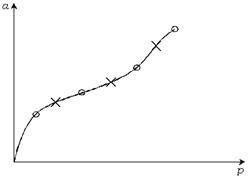
Рис. 3.7. Изотерма адсорбции  на
на 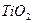 и
и 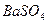 .
.
Адсорбция зависит от величины поверхности адсорбента и от энергии взаимодействия между поверхностью и газом. Энергия взаимодействия характеризуется теплотой физической адсорбции, которая примерно равна теплоте конденсации газа и не зависит от адсорбента. Решающим фактором в физической адсорбции является не природа адсорбента, а величина его поверхности.
В отличие от физической адсорбции хемосорбция специфична, т. е. данное вещество хемосорбируется только на определенных адсорбентах. В хемосорбции более важен энергетический фактор, а не величина поверхности.
При хемосорбции адсорбция возможна вследствие самопроизвольного уменьшения энергии Гиббса всей системы, что может привести даже к увеличению поверхностной энергии. Это возможно в том случае, если 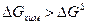 .
.
Дата добавления: 2020-11-18; просмотров: 913;











