Метод избыточных величин Гиббса
Для определения характера изменения термодинамических свойств в поверхностном слое необходимо знать его протяженность, т. е. объем или толщину. Свойства поверхностного слоя идентичны свойствам фазы на бесконечно большом расстоянии от поверхности раздела. Толщина поверхностного слоя 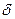 неизвестна, неопределенна, т. к. поверхностный слой переходит в объемную фазу непрерывно. Значение d трудно определить экcпериментально вследствие малой величины и большой погрешности определений или рассчитать теоретически.
неизвестна, неопределенна, т. к. поверхностный слой переходит в объемную фазу непрерывно. Значение d трудно определить экcпериментально вследствие малой величины и большой погрешности определений или рассчитать теоретически.
У. Гиббс в 1876 г. предложил метод описания термодинамики поверхностного слоя, основанный на исключении неопределенности значения 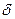 . Гиббс от реальной системы перешел к идеальной, заменив поверхностный слой разделяющей поверхностью, которая проводится внутри поверхностного слоя. Фазы
. Гиббс от реальной системы перешел к идеальной, заменив поверхностный слой разделяющей поверхностью, которая проводится внутри поверхностного слоя. Фазы 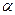 и
и 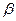 включают часть поверхностного слоя и считаются однородными вплоть до разделяющей поверхности. Гиббс предложил относить все изменения термодинамических параметров в слое по сравнению с объемными фазами к разделяющей поверхности, не имеющей объема, или толщины. Гиббс ввел два понятия: поверхность разрыва и разделяющую поверхность.
включают часть поверхностного слоя и считаются однородными вплоть до разделяющей поверхности. Гиббс предложил относить все изменения термодинамических параметров в слое по сравнению с объемными фазами к разделяющей поверхности, не имеющей объема, или толщины. Гиббс ввел два понятия: поверхность разрыва и разделяющую поверхность.
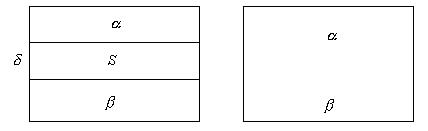
Рис. 2.6.
Поверхностный слой Гиббс называет поверхностью разрыва, понимая под этим неоднородный тонкий слой, разделяющий объемные фазы и обладающий конечной толщиной и объемом. Разделяющая поверхность – геометрическая поверхность, воспроизводящая форму поверхности разрыва и располагающаяся параллельно ей. Разделяющая поверхность - фиктивная, воображаемая поверхность, на которой происходит разрыв непрерывности в плоскостях  состава. Каждая точка вещества на поверхности находится в одинаковых условиях. Положение поверхности фиксируют, выбирая определенную величину адсорбции на поверхности.
состава. Каждая точка вещества на поверхности находится в одинаковых условиях. Положение поверхности фиксируют, выбирая определенную величину адсорбции на поверхности.
Разность между соответствующими экстенсивными величинами в реальной и идеальной системе представляет собой избыточную величину, которую относят к разделяющей поверхности. Посредством этих избытков выражаются все экстенсивные параметры в методе Гиббса, поэтому этот метод называется методом избыточных величин.
Фактически величины экстенсивных параметров для всей системы в целом несколько отличаются от их суммы для двух объемных фаз. Эту разность, положительную или отрицательную, относят к разделяющей поверхности. При таком рассмотрении поверхность характеризуется избыточными термодинамическими параметрами, отражающими проявление поверхностной энергии. В соответствии с методом избыточных величин энергия Гиббса двухфазной системы равна сумме энергий Гиббса отдельных фаз и поверхностной энергии Гиббса 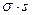 , которая является избыточной.
, которая является избыточной.
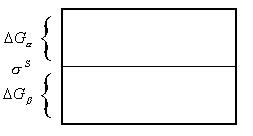
Рис. 2.7. Энергия Гиббса двухфазной системы с разделяющей поверхностью.

Избыток числа молей компонентов на поверхности
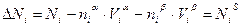
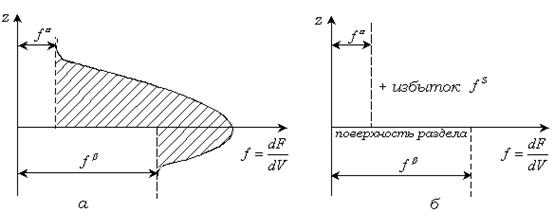
Рис. 2.8. Изменение плотности свободной энергии на межфазной границе в реальной системе ( 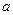 ) и в модели Гиббса (б)
) и в модели Гиббса (б)
Таким образом, в методе Гиббса свойства реальной системы отождествляются со свойствами идеальной системы, состоящей из двух фаз с разделяющей поверхностью, в которой сосредоточены избытки термодинамических свойств. Изменение плотности свободной энергии на границе фаз в реальной и идеальной системе показано на рис.
Метод Гиббса имеет существенные недостатки. Он применим только к гетерогенным системам, состоящим из двух жидких фаз или жидкой и газообразной фазы. Проведение сравнения реальной и идеальной систем и избыточных функций приводит к формальным затруднениям. Избыточные параметры зависят от положения разделяющей поверхности. Наконец, этот метод не позволяет рассмотреть свойства поверхностного слоя.
От этих недостатков свободен второй метод, называемый методом слоев конечной толщины. Согласно этому методу определяются не избыточные, а полные значения термодинамических параметров в поверхностном слое. Избыток энергии Гиббса в системе определяется суммой избытков энергии Гиббса в каждой фазе и в поверхностном слое

Все величины, определяемые этим методом, имеют ясный физический смысл. Однако, трудно определять толщину поверхностного слоя вследствие малой величины и неопределенности этой характеристики.
2.6. Фундаментальное уравнение Гиббса для свободной энергии гетерогенной системы с плоской границей раздела фаз
Пусть в гетерогенной системе, не способной к обмену компонентами со средой, т. е. закрытой системе, состоящей из газообразной фазы 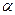 и жидкой фазы
и жидкой фазы  объем увеличился на
объем увеличился на  , а величина поверхности на
, а величина поверхности на  .
.
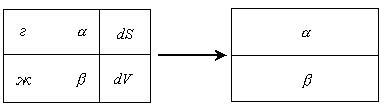
Рис. 2.9.
При этом совершается работа 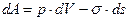 . Поскольку увеличение объема происходит самопроизвольно, первый член этого выражения означает работу, совершенную системой самопроизвольно вследствие теплового движения. Увеличению поверхности система противится, поэтому второй член означает работу, совершенную над системой вследствие притока тепла извне.
. Поскольку увеличение объема происходит самопроизвольно, первый член этого выражения означает работу, совершенную системой самопроизвольно вследствие теплового движения. Увеличению поверхности система противится, поэтому второй член означает работу, совершенную над системой вследствие притока тепла извне.
Согласно первому закону термодинамики 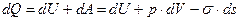 . Согласно второму закону термодинамики при установлении равновесия
. Согласно второму закону термодинамики при установлении равновесия 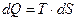 . Объединим уравнения первого и второго закона термодинамики при установлении равновесия
. Объединим уравнения первого и второго закона термодинамики при установлении равновесия 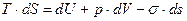 .
.
1) 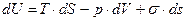
Перейдем от внутренней энергии к свободной энергии, т.е. заменим 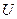 на
на 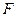 .
. 
2) 
Объединим уравнения 1) и 2)


Это - уравнение для закрытой гетерогенной системы с плоской границей раздела. Для открытой системы учитывается вещественный обмен, т.к. число молекул в системе может изменяться, и уравнение принимает вид:
3) 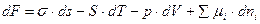
Это уравнение отличается от уравнения для гомогенной системы членом 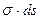 , обозначающим работу образования поверхности. Из этого уравнения видно, что с увеличением поверхности увеличивается свободная поверхностная энергия. При увеличении числа компонентов также происходит увеличение свободной поверхностной энергии.
, обозначающим работу образования поверхности. Из этого уравнения видно, что с увеличением поверхности увеличивается свободная поверхностная энергия. При увеличении числа компонентов также происходит увеличение свободной поверхностной энергии.
2.8. Уравнение Гиббса для плоского поверхностного слоя
Плоским поверхностным слоем называется такой слой, толщина которого много меньше радиуса кривизны, т. е. система отвечает условию: 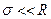 .
.
Для всей системы изменение свободной энергии определяется выражением 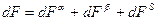 . Согласно выражению, полученному для системой с плоской границей раздела
. Согласно выражению, полученному для системой с плоской границей раздела 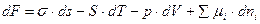 .
.
В соответствии с методом избыточных величин Гиббса изменение свободной энергии в поверхностном слое равно  . Для каждой объемной фазы справедливо выражение
. Для каждой объемной фазы справедливо выражение
4) 
5) 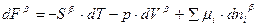
В этих выражениях у mi нет индекса, т.к. при равновесии значения химического потенциала в обеих фазах выравниваются. Вычитая из выражения (3) выражения (4) и (5) и учитывая, что экстенсивные свойства 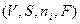 суммируются и что при достижения равновесия
суммируются и что при достижения равновесия 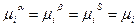 , получим
, получим 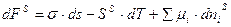
Свободная энергия поверхностного слоя складывается из трех членов: работы увеличения поверхности раздела фаз, энтропийного члена, учитывающего изменение связанной энергии системы и члена, учитывающего вещественный обмен между фазами и поверхностным слоем, т.е. состав поверхностного слоя.
Проанализируем это уравнение.
1. Возьмем частную производную 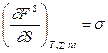 . Отсюда получаем физический смысл
. Отсюда получаем физический смысл 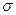 , качественной характеристики поверхности. Поверхностное натяжение - это изменение свободной энергии поверхностного слоя, приходящееся на единицу увеличения поверхности. Чтобы увеличить поверхность, надо совершить работу. Отсюда вытекает второе определение: поверхностное натяжение - это обратимая изотермическая работа образования единицы поверхности, которая затрачивается на преодоление сил межмолекулярного взаимодействия и переходит в свободную поверхностную энергию.
, качественной характеристики поверхности. Поверхностное натяжение - это изменение свободной энергии поверхностного слоя, приходящееся на единицу увеличения поверхности. Чтобы увеличить поверхность, надо совершить работу. Отсюда вытекает второе определение: поверхностное натяжение - это обратимая изотермическая работа образования единицы поверхности, которая затрачивается на преодоление сил межмолекулярного взаимодействия и переходит в свободную поверхностную энергию.
Объединенное уравнение первого и второго начал термодинамики может быть записано и относительно других характеристических функций, а именно, энергии Гиббса 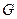 , внутренней энергии
, внутренней энергии  , энтальпии
, энтальпии 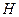 . При соответствующих постоянных параметрах получим:
. При соответствующих постоянных параметрах получим:

Таким образом, поверхностное натяжение есть частная производная от любой характеристической функции по площади межфазной поверхности при постоянных соответствующих параметрах.
Наиболее часто поверхностное натяжение выражают через производную от энергии Гиббса, ибо условия 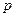 и
и 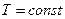 легко осуществимы экспериментально. Для конденсированных систем можно пользоваться и производной от энергии Гельмгольца, т.к. изменение объема от давления в конденсированных системах мало.
легко осуществимы экспериментально. Для конденсированных систем можно пользоваться и производной от энергии Гельмгольца, т.к. изменение объема от давления в конденсированных системах мало.
Единицы измерения поверхностного натяжения:
в Си 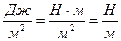
в СГС 
2.  . Экспериментально доказано, что на границе жидкости или твердого тела с газом с повышением температуры поверхностное натяжение уменьшается, т.к. увеличивается расстояние между молекулами и уменьшается межмолекулярное взаимодействие.
. Экспериментально доказано, что на границе жидкости или твердого тела с газом с повышением температуры поверхностное натяжение уменьшается, т.к. увеличивается расстояние между молекулами и уменьшается межмолекулярное взаимодействие.  . Следовательно,
. Следовательно, 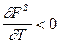 и
и 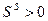 .
.
Поверхностный слой на границе жидкости или твердого тела с газом обладает избыточной энтропией, которая всегда положительна. Причиной этого является переход молекул в менее плотную фазу, молекулы имеют больше степеней свободы.
3. 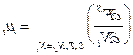 .
.
Химический потенциал - это мольное приращение свободной энергии при постоянном объеме при переходе i-го компонента в поверхностный слой. Химический потенциал характеризует скорость, с которой меняется свободная энергия при изменении концентрации данного вещества. Химический потенциал является движущей силой химических реакций. Аналогично поверхностному натяжению химический потенциал можно выразить как частную производную характеристической функции по концентрации.
Дата добавления: 2020-11-18; просмотров: 2035;











