Понятия обратимых и необратимых процессов 8 глава
Чижевский А.Л. (1973 г.) считал, что дзета-потенциал – это электрический потенциал на границе раздела двух фаз – поверхности клетки крови и ее плазмы.
При перемещении в электрическом поле клеток крови с двойным электрическим слоем их поверхность смещений не совпадает с разделом твердой и жидкой фаз, а сдвигается в глубину последней. Скачок потенциала, который образуется на границе отрыва клетки с прочно фиксированным слоем ионов, по отношению к остальной массе жидкости был назван электрокинетическим или дзета-потенциалом (Харамоненко С.С., Ракитянская А.А., 1974 г.).
По современным представлениям о строении двойного электрического слоя крови, противоионы на поверхности клетки удерживаются силами специфической адсорбции. Этот слой поэтому называется адсорбционным. Противоионы адсорбционного слоя всегда перемещаются вместе с частицами дисперсной фазы. Остальная часть противоионов образует диффузионный слой, который может отставать от движения клетки с адсорбционным слоем в однородном электрическом поле. Полная разность потенциалов между дисперсной фазой и дисперсной средой называется электродинамическим потенциалом. Разность потенциалов между адсорбционным слоем и дисперсной средой и будет являться электрокинетическим, или дзета-потенциалом.
Д. Tэйлор (1978 г.), Г.И. Козинец, Г.Г. Иванов (1981 г.), М.П. Попов (1982 г.), Д.Н. Зюбан (1985 г.) подчеркивают особое значение электрокинетических явлений в циркуляции и стабильности суспензии крови. Показано, что стабильность коллоидной суспензии связана с дзета-потенциалом (Чижевский Л.Л. (1972 г.); Кузник Б.И. (1974 г.)). Этот потенциал форменных элементов расположен между 15…20 мВ (Соловьев Г.М., Радзивилов Г.Г. (1973 г.), Попов М.П., Зюбан Д.И., (1989 г) и др.).
Дзета-потенциал образуется в очень тонком слое жидкости, прилетающем к дисперсионной фазе, и при том в направлении, перпендикулярном к направлению движения фазы или среды. Его нельзя замерить при помощи микроэлектродов, поэтому его величину рассчитывают только косвенно, по скорости движения фаз в электрическом поле, используя формулу Эйншгейна-Смолуховского:
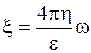 (5.7)
(5.7)
где ω - подвижность частицы или клетки;
h- вязкость среды;
ε- диэлектрическая постоянная среды.
При расчетах дзета-потенциала, как правило, величину вязкости раствора (h), диэлектрической проницаемости (ε) принимают за постоянную. По Weiss (1969 г.), С.Г. Харамоненко (1972 г.) и др., при 18 °С вязкость изотонического раствора равна 0,01 пуаз, относительная диэлектрическая проницаемость ms=81. Авторы предлагают рассчитывать дзета - потенциал по формуле
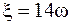 (5.8)
(5.8)
где ω – электрофоретическая подвижность клетки.
Мы не разделяем эту точку зрения, так как при различных патологических состояниях организма наблюдаются изменения реологических свойств кровотока. В широких пределах колеблется вязкость, нарушается диэлектрическое равновесие среды. Поэтому необходимо учитывать не только энергетическое состояние клетки, но и величину вязкости, а также диэлектрической проницаемости среды. Однако многие исследователи ставят знак равенства между данными двумя, разнородными по своей биофизической сущности, величинами.
Из-за отсутствия четкого понимания патогенеза тромбоза не существует и адекватного метода, позволяющего определить тенденцию крови к тромбообразованию.
Изменение функционального состояния тромбоцитов и эритроцитов играет большую роль в процессе тромбообразования. Это дало основание для дальнейшего тщательного изучения этих свойств. Одним из направлений в изучении функциональных свойств клеток крови является исследование их электрокинетических параметров - электрофоретической подвижности, дзета-потенциала, величины поверхностного электрического заряда. Снижение этих биофизических величин клеток крови ведет к повышению их агрегационных и адгезивных свойств. Запуск системы свертывания крови связывают с изменением величины дзета-потенциала, значения которого обусловлены сдвигами концентрации электролитов в крови.
В настоящее время определение электрофоретической подвижности (ЭФП) широко используется для характеристики функциональных свойств клеток крови, так как она является чувствительным тестом различных патологических состояний организма. В норме ЭФП эритроцитов человека равна ω=[1,30±0,50] м2/(В·с).
5.2. Определение поверхности электрического заряда эритроцитов
Из сравнительно небольшого числа методов по определению электрических параметров крови наиболее информативным является метод электрофореза красных клеток крови. Поэтому нам кажется необходимым более подробно на нем остановиться.
Электрофорез - это явление передвижения коллоидных частиц в постоянном электрическом поле к полюсу, знак заряда которого противоположен знаку заряда коллоидных частиц. Поэтому, наблюдая электрофорез, можно определить знак заряда коллоидной частицы. Изучать количественно электрофорез можно двумя путями: во-первых, макроскопически, когда наблюдают скорость передвижения границы коллоидный раствор - "боковая" жидкость ("боковая" - это жидкость, непосредственно граничащая с золем); во-вторых, микроскопически, когда наблюдают за движением частиц с помощью микроскопа. При микроэлектрофорезе, при использовании плоской камеры, ее ширина а во много раз должна превышать ее глубину b, то есть должно соблюдаться условие
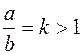 . (5.9)
. (5.9)
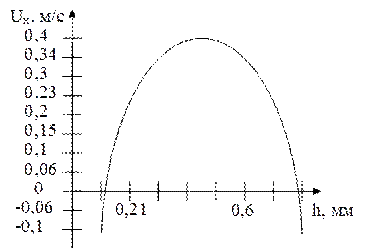
Рис. 5.1. Кривая зависимости наблюдаемой скорости
На рисунке 5.1 дана кривая, которая показывает изменение скорости микроскопических масляных капель на разных уровнях в плоской камере для электрофореза, которая имела глубину 0,6 мм (Путилова Е.Н. (1989 г.)). Как видно из графика, скорость частиц линейно зависит от того, на каком уровне они расположены. У стенок, вследствие электроосмоса, частицы могут передвигаться в обратном направлении.
Если v- скорость движения частиц относительно жидкости, обусловленная их зарядом; vнабл - наблюдаемая скорость передвижения частиц; U- скорость самой жидкости, среды, в которой взвешены частицы или клетки крови (в частности, эритроциты), то на любом расстоянии а от стенки камеры будет справедливо уравнение
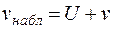 . (5.10)
. (5.10)
Скорость движения частиц относительно жидкости, при наличии постоянного напряжения на электродах, должна быть одинакова на всех уровнях камеры: скорость vнабл и U должны изменяться с изменением высоты уровня. Если камера закрыта, то количество жидкости, передвигающейся в одном направлении, равно количеству жидкости, перемещающемуся в обратном направлении, то есть
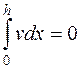 , (5.11)
, (5.11)
где h - глубина камеры, мм; х - уровень, на котором производится измерение наблюдаемой или, как ее часто называют в литературе, линейной скорости; v- скорость перемещающейся среды, м/с.
Для того чтобы поддержать гидростатическое равновесие, должен иметь место противоток жидкости в центральной части просвета камеры, так как взвешенные в этих слоях частицы уносятся движущейся жидкостью, как если бы они подвергались электрофорезу. Для плоской камеры имеются приблизительные расчеты, показывающие, что в двух участках камеры можно гарантировать движение частиц, обусловленное только одним электрофоретическим смещением.
Расчеты некоторых исследователей (Захарченко В.П., 1974) и др.) показывают, что в плоской камере эти участки неподвижной жидкости находятся на глубине 0,21h и 0,789h, а в цилиндрической камере неподвижный слои находится на расстоянии 0,147d от стенки цилиндра. Благодаря тому, что стенки цилиндрической камеры действуют подобно линзе, трудно определить глубину, на которую может быть сфокусирован микроскоп, поэтому цилиндрические камеры получили меньшее распространение в методике микроэлектрофореза.
Остановимся на подсчете истинного значения электрофоретической скорости, что очень важно для проводимых исследований по определению точного значения величины дзета-потенциала. Примем, что линейные размеры камеры соответствуют условиям формулы (5.9):
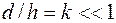 ,
,
где d - ширина камеры, см;
h – глубина рабочей ячейки камеры, мм.
Так как указанные выше глубины, на которых необходимо производить измерения, действительны только при условии, когда отношение ширины к глубине камеры больше 20, то, учитывая формулу (5.11) получим
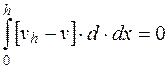 ; (5.12)
; (5.12)
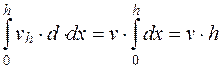 ; (5.13)
; (5.13)
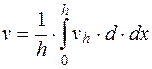 . (5.14)
. (5.14)
Таким образом, истинное значение электрофоретической скорости частиц (или клеток) является средней величиной наблюдаемых (линейных) скоростей движения частиц в каждом отдельном перемещающем слое.
Для нахождения истинной электрофоретической скорости нужно ввести измерение VH на разных глубинах от верхней стенки и проинтегрировать. Одним из точных, но трудоемких методов является графический способ определения vH. Для этой цели строят график функции vH=f(h).
При проведении экспериментов по определению постоянного значения электрофоретической скорости эритроцитов и тромбоцитов крови животных и человека (в исходном состоянии) строят контрольные графики в каждой серии опытов.
Метод графического определения истинного значения электрофоретической скорости является одним из наиболее точных, однако он требует большой затраты времени, и поэтому лучше использовать его в качестве контрольного. По той же причине многие экспериментаторы стремятся изыскать пути, которые позволили бы на малом числе глубин измерения линейной скорости найти истинное значение электрофоретической скорости.
Этим объясняется расхождение в предлагаемых формулах для нахождения данного параметра. Тарусов Б.Н. (1970 г.) предлагает определить истинное значение по следующей формуле:
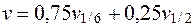 , (5.15)
, (5.15)
где v - истинное значение электрофоретической скорости форменных элементов крови;
v1/6 - наблюдаемая (линейная) скорость на 1/6 глубины камеры.
В то же время другие (Пунцова Е.Н. (1960 г.)) предлагают формулу
 , (5.16)
, (5.16)
где v0 - наблюдаемая (линейная) скорость на уровне х= 0, то есть на поверхности ячейки.
Такого рода расхождения объясняются выбором ячейки камеры определенных геометрических размеров, при учете глубин, на которых наблюдается только электрофоретическое перемещение частиц (или клеток).
Показано (Захарченко В.Н., 1974), что вызванное электроосмосом движение жидкости (среды, в которой взвешены частицы) в плоской камере следует параболической кривой, причем в одном правлении перемещение достигает максимума вблизи стенок, а в другом - в центре камеры. Если эта параболическая кривая симметрична относительно камеры, а уровни, на которых V=0 определены правильно, то электроосмотическое движение жидкости у каждой (верхней и нижней) стенки должно быть одинаково. Чем меньше глубина камеры, тем больше изменяется скорость электроосмотического движения жидкости с глубиной и тем тоньше слой, в котором это движение в обоих направлениях минимально.
При нахождении слоя, где U=0, необходимо, чтобы длина оптического пути от дна камеры до наружной поверхности верхней стенки ячейки камеры была меньше фокусного расстояния объектива, разрешающая способность которого достаточна для рассмотрения частиц. Если наблюдения ведутся над очень мелкими частицами, то обычно используются водные или масляные иммерсионные объективы, а величина просвета и толщины стенки камеры берутся минимальными. Глубина камеры при этом соответствует 0,5-0,6 мм, то есть меньше единицы.
В основе расчета нахождения слоя жидкости, скорость которого стремится к нулю в зависимости от глубины камеры, лежит формула Смолуховского
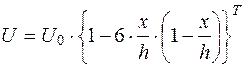 , (5.17)
, (5.17)
где U0 - скорость у стенок камеры;
U - скорость на произвольной глубине камеры;
х - произвольная глубина.
Если принять U=0, то, согласно уравнению (5.10), v=vH. Решая уравнение (5.17) относительно х, при U=0 найдём:
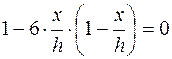 , (5.18)
, (5.18)
получим

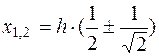 . (5.19)
. (5.19)
Следовательно, при х1= 0,21·h и х2=0,79·h, наблюдаемые значения электрофоретической скорости форменных элементов равны истинному значению электрофоретической скорости. Таким образом, истинная электрофоретическая скорость частиц, а в нашем случае форменных элементов крови (эритроцитов, тромбоцитов), является средней скоростью всех наблюдаемых линейных скоростей в каждом отдельном слое или вблизи лежащих слоев, у которых U~0. Следовательно, электрофоретическая подвижность равна
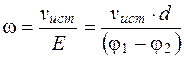 (5.20)
(5.20)
где 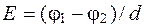 - градиент потенциала, В/м;
- градиент потенциала, В/м;
j1-j2 - разность потенциала между электродами, В;
d - расстояние между электродами, см.
Если принять, что электрическое поле однородно на всех участках ячейки, то величину напряженности однородного электрического поля можно вычислить, исходя из геометрических размеров ячейки, приняв её за проводник и использовав для этого закон Ома в дифференциальной форме:
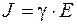 или
или 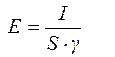 , (5.21)
, (5.21)
где J - величина тока, А;
S - поперечное сечение камеры, мм2;
g - электропроводность среды, См.
Главным параметром, позволяющим определить электрическую подвижность форменных элементов крови, а в дальнейшем - дзета-потенциал их, является истинная электрофоретическая скорость, которая, естественно, как и подвижность, является для данного величиной постоянной.
Точность метода микроэлектрофореза резко падает при определении величины, исходя из одного и даже только из двух значений линейных скоростей, так как очень трудно, почти невозможно, вести замер в слоях, где можно гарантировать, что U=0.
Некоторые исследователи (Ракитянская А.Д., 1972; Харамоненко С.С., 1974) исходят из того положения, что если x/h=1/2, то выражение (5.17) примет вид
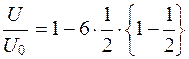 . (5.22)
. (5.22)
Учитывая предыдущие выражения, получим:
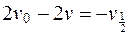 ;
; 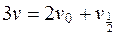 . (5.23)
. (5.23)
Следовательно,
 . (5.24)
. (5.24)
Таким образом, мы еще раз подтвердили, что линейные скорости измеряются на предполагаемых, в зависимости от геометрических размеров ячейки, слоях, где U=0. То есть скорость зависит от соотношения x/h. С другой стороны, анализ последних выражений показывает, что для расчета ЭФП форменных элементов крови по формуле (5.13) требуется экспериментально определить лишь значение электрофоретического времени движения клеток в однородном электрическом поле. Действительно, формулу (5.13) можно представить как:
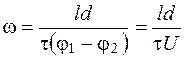 , (5.25)
, (5.25)
где l - расстояние по окуляр-микрометру, пройденное клеткой, м;
τ - время движения клетки, с.
Три параметра l, d и U в процессе экспериментальной работы можно держать постоянными. Используя формулу (5.17) для определения ЭФП, кроме движения клеток, необходимо экспериментально определить удельную проводимость клеточных мембран по формуле
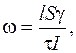 (5.26)
(5.26)
Заменив v=Sl, получим
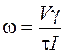 ,
,
где V - объем рабочей ячейки, м3;
τ – электрофоретическое время движения клеток, с;
I – величина тока, А.
Определяя одновременно у одного и того же образца крови электрофоретическое время движения клеток и удельную электропроводимость среды мостом полной проводимости Е-10-2, получается незначительная разность в экспериментальных данных. Она соответствовала ≈22%.
Одновременное фиксирование двух экспериментальных величин дает более точные результаты определения ЭФП форменных элементов крови.
Большое значение имеет конструкция и размер камеры. Как было показано, конструкция, и выбор камеры для микроэлектрофореза зависит от геометрических размеров рабочей ячейки, которые определяются соотношением ширины к ее глубине. Выбор конструкции камеры по этому соотношению производится в зависимости от размеров частиц исследуемого объекта.
Если придерживаться расчетов, приведенных выше для плоской камеры, скрытого или закрытого типа, то они показывают, что участки неподвижной жидкости (U=0) должны находиться на 0,211 и 0,789 ее глубины, и это соотношение не должно превышать 20.
Самым распространенным типом камер, используемых для определения истинного значения электрофоретической скорости, являются плоские камеры открытого или закрытого типа. Эти широко используемые камеры изготовляются из малых покровных стекол, которые наклеиваются на широкое покровное стекло. Основной частью камеры является капилляр (рабочая ячейка камеры) с плоскопараллельными стенками, толщина капилляра равна 0,6 мм, ширина 13 мм, длина 35 мм и имеет отношение ширины к высоте камеры больше 20.
При глубине 0,6 мм отдельные исследователи считают необходимым производить измерения электрофоретической скорости на 1/15 глубины камеры. Некоторые из них (Харамоненко С.С., 1974) считают, что данные можно снимать на одной глубине, при которой электрофоретическая скорость соответствует истинному значению (в остальных случаях она искажается, вследствие осмотического тока жидкости).
Мы считаем, что не только по одному измерению на одной глубине, но даже на двух глубинах камеры, почти невозможно оценить истинное значение этого параметра. Объясняется это тем, что при широкой, поточной экспериментальной работе невозможно предварительно рассчитать, сфокусировать, а может быть вообще определить истинное значение скорости в связи с небольшими размерами и малым числом клеток, например тромбоцитов, на какой-то определенной глубине рабочей ячейки камеры (где U=0).
В этом отношении упрощается работа с камерой, имеющей цилиндрическую ячейку. Сделать такую камеру намного легче. В этом также ее преимущество. Используется простая капиллярная трубка диаметром 0,5…1,0 мм со сточенной и отшлифованной плоской поверхностью в том месте, где будут производиться наблюдения под микроскопом. В этом же месте и склеиваются электроды. Расчет глубин в цилиндрических камерах, на которых U=0, производится следующим образом.
Скорость жидкости в цилиндрической камере на расстоянии l от оси капилляра можно выразить уравнением
 , (5.27)
, (5.27)
где h - вязкость крови, Р - градиент гидростатического давления в направлении, параллельном оси трубки; r - радиус капилляра, мм.
На внутренней поверхности рабочей ячейки камеры можно предположить, что r=1, а U=U0:
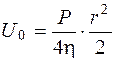 , или
, или 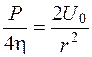 (5.28)
(5.28)
Так как наблюдаемая линейная скорость частиц (клеток) равна 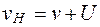 , то можно установить
, то можно установить
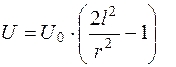 . (5.29)
. (5.29)
При U=0 получим
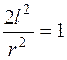 ; (5.30)
; (5.30)
при r=0,65  ; при r=1
; при r=1 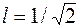 .
.
Следовательно,
 , то есть v=vH.
, то есть v=vH.
Для повышения точности по определению электрофоретической роста клетки при работе с камерой, имеющей цилиндрическую ячейку, стремятся использовать два капилляра, радиус и длина которых находятся между собой в определенных отношениях. В целом, это представляет некоторое усовершенствование камер с цилиндрическими ячейками (Харамоненко С.С., 1974). Однако цилиндрические ячейки выполняют роль линзы, и при фокусировке микроскопа (это являлся основным недостатком) нельзя точно наблюдать скорость движения частиц на строго фиксированной глубине, даже если скорость жидкости равна нулю. Поэтому такие камеры используют гораздо реже, чем плоские камеры открытого и закрытого типа.
К типичным плоским камерам закрытию типа можно отнести камеру Бриггса и Абрамсона (1929). Камера Абрамсона построена из пирекса. Плоская часть рабочей ячейки сделана из полированных стеклянных пластинок толщиной 0,6 мм, расположенных на расстоянии 0,6 мм друг от друга. Камера Бриггса сделана также из пирекса. Плоская часть ее склеена из изолированных пластинок толщиной 1,0 мм, расположенных на расстоянии 0,8 мм друг от друга. Камера Абрамсона характерна тем, что она позволяет использовать несколько большие увеличения, чем другие камеры (м = 0,6), в которых длина оптического пути от наружной поверхности верхней стеклянной пластинки до дна камеры несколько больше. Однако следует пояснить, что при уменьшении глубины камеры параболическая кривая, полученная вследствие измерения линейных скоростей на разных уровнях, становится круче, и с увеличением ее крутизны точность установки резко снижается. Наши наблюдения показывают, что глубина камеры меньше 0,6мм искажает истинное значение электрофоретической скорости.
Блок питания соединяется с рабочей ячейкой камеры при помощи электродов, которые оказывают существенное влияние на ее конструктивные особенности. При микроэлектрофорезе, как вообще при всех биологических исследованиях, используются неполяризующие электроды. Эксперименты показывают, что металлические неполяризующие электроды для микроэлектрофореза приемлемы, но работать с ними неудобно, потому что приходится после каждого длительного эксперимента (2-3-х часов работы) вновь платинировать или хлорировать электроды. Было также показано, что при работе с металлическими электродами с частичной ликвидацией покрытия наблюдаются отклонения в регистрируемых данных. Поэтому при проведении экспериментальной работы обычно рекомендуют агар-агаровый мостик - один из устойчивых видов неполяризующихся элементов. Более подробно на неполяризующихся электродах разного типа остановимся ниже.
По обычной методике агар-агаровые неполяризующие электроды приготавливают следующим образом. К плоской камере с рабочей ячейкой открытого типа на других предметных стеклах приклеивают обрезанные пробирки с плоскими донышками (высотой до 1 см), которые служат стаканчиками для растворов CuSО4 и КСl. Из стеклянных трубок вытягиваются U-образные трубочки и сифончики. В сифончики и U-образные трубочки насасывается 3%-ый раствор агар-агара, приготовленный на насыщенном растворе KCl.
Камеру с неполяризующимися электродами помещают на столик микроскопа и включают в электрическую цепь по общепринятой для микроэлектрофореза схеме. В рабочую ячейку вносится капля жидкости с взвешенными в ней клетками, которые подлежат исследованию, после чего камера накрывается покровным стеклом. При сборке установки тщательно следят за тем, чтобы между жидкостью в камере и раствором агар-агара в сифончиках был обеспечен надежный контакт.
Исходя из теории микроэлектрофореза, как уже отмечалось, необходимым условием работы камеры является условие 1/h>20, ширина d при h = 1мм должна быть не менее 2 см, иначе неполяризующие электроды такого рода не смогут создать в рабочей ячейке однородного электрического поля, так как будет создаваться значительный градиент напряженности, который непременно приводит к большим искажениям в экспериментальных данных по определению истинного значения электрофоретической скорости исследуемых частиц. Кроме того, вся система неполяризующихся электродов крайне неустойчива в работе.
Эти два аргумента не дают возможности использовать эту, широко описанную в литературе, методику для определения ЭФП форменных элементов крови. Следует также отметить, что камеру с ячейкой закрытого типа и такого рода неполяризующимися электродами сделать трудно, так как необходимо предусматривать систему, которая смогла бы обеспечить хорошую промывку и смену агар-агара в электродах. В этом отношении лучше подходят плоские камеры с ячейкой, как закрытого, так и открытого типа, с металлическими электродами.
Однако недостатки, указывающие на невозможность при длительной работе камеры полного исключения вторичных реакций, хлорированные или платированные (в зависимости от вида) электроды также не гарантируют устойчивого снятия истинного значения электрофоретической скорости исследуемого объекта.
Опыты показывают, что при создании установки для микроэлектрофореза и расчета результатов экспериментов необходимо учитывать факторы, влияющие на степень точности их параметров. К ним относятся:
1. Правильный расчет геометрических соотношений размеров рабочей ячейки камеры от ее вида.
2. Учет особенностей оптического хода светового луча для фокусировки микроскопа при использовании фазовоконтрастной приставки.
3. Выбор неполяризующихся электродов и правильное их изготовление.
4. Полное исключение теплового эффекта, усиливающего беспорядочное хаотическое движение частиц и осмотический круговорот вследствие перепада давлений в камере.
5. Правильный выбор измерительной аппаратуры при сборке установки.
6. Правильный выбор блока питания и проверка выпрямления тока методом осциллографии.
7. Особенности нахождения глубин, на которых производится определение линейных электрофоретических скоростей.
8. Создание в рабочей ячейке камеры однородного электрического поля.
9. Соблюдение строго постоянного объема изучаемого объекта.
10. Выбор математического метода для обработки экспериментальных данных при микроэлектрофорезе.
Исходя из этого, создана камера, рабочая ячейка которой имеет геометрические размеры 1 ±0,1 мм к 20,2±1 мм. Камера сделана из оргстекла (рис. 5.2). Поэтому при изготовлении серьезное внимание уделено шлифовке нижнего и верхнего основания ее рабочей ячейки.
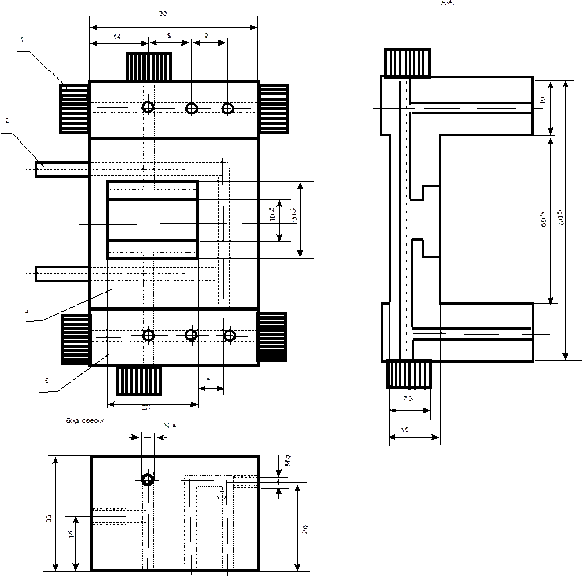
Рис 5.2. Камера для микроэлектрофореза
Толщина камеры имеет минимальные размеры, которые возможны при создании этого типа камер. Это обеспечивает необходимый оптический путь луча при наблюдении исследуемых микрообъектов. Сверху камера закрывается платой (пробкой), в нижнем основании которой находится покровное стекло. В верхнем основании высотой до 5 мм сделан цилиндрический вырез по диаметру объектива.
Наблюдения в камере производятся с помощью фазовоконтрастного объектива, диаметр которого при увеличении 20 х 15 = 300 равен 1,5 см.
Площадь нижнего основания пробки имеет размеры 20 мм х 10 мм. Допуск ± 2 мм по ширине камеры создан для того, чтобы избежать возникновения пузырьков воздуха при закрытии пробкой рабочей ячейки камеры с находящимся в ней исследуемым объектом.
Таким образом, при использовании пробки мы получаем камеру с закрытой рабочей ячейкой. Если использовать покровное стекло, то осуществляется переход от закрытой камеры к камере с открытым типом. Камера открытого типа более удобна в работе. Ее рабочую ячейку легко заполнить исследуемым объектом и промывать после работы.
Однако вследствие того, что покровное стекло плотно не прикрывает верхнее основание рабочей ячейки камеры, часто нарушается осмотический кругооборот жидкости. Более приемлема конструкция такой рабочей ячейки, которая бы легко заполнялась и промывалась, с сохранением всех основных параметров расчета, применяемых для плоских камер. Должна быть создана такая конструкция пробки, которая должна соответствовать нормативам, вытекающим из расчета, применяемого для плоских камер.
При создании камеры необходимо остановиться на выборе неполяризующихся электродов из агар-агарового мостика. В отличие от систем, используемых для таких электродов, желательно применить устойчивую конструкцию, например, состоящую из щечек, плотно приклеенных (дихлорэтаном) к боковым основаниям камеры. В отверстия, соединенные в нижнем и верхнем основании их, можно помещать агар-агар, разбавленный 3%-ым КСl и серной кислотой. Через серную кислоту происходит соединение посредством хлорсеребряных электродов рабочей ячейки камеры с блоком питания установки. Агар-агар заполняет продольное отверстие камеры, соединенное с рабочей ячейкой. В рабочей ячейке сделаны параллельные пазы (вырезы) на расстоянии 1 см друг от друга, которые также заполняются агар-агаром. Агар-агар, находящийся в параллельных пазах, непосредственно контактирует с исследуемым объектом.
Дата добавления: 2020-11-18; просмотров: 404;











