Молярна теплоємність - величина рівна кількості теплоти, яка необхідна для нагрівання 1 моля речовини на 1 К
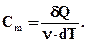 (2.41)
(2.41)
Одиниця молярної теплоємності (Дж/(моль·К). Питома теплоємність пов'язана з молярною співвідношенням:
Cm=c·M.(2.42)
Розрізняють молярні теплоємності при сталому об'ємі і сталому тиску Cv і Cp
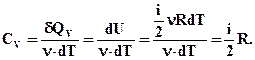 (2.43)
(2.43)
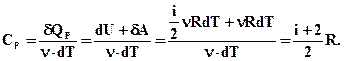 (2.44)
(2.44)
Порівнюючи теплоємності Cv і Cp отримаємо:
СР=Сv+R.(2.45)
Цей вираз називається рівнянням Майєра. З нього виходить, що Ср завжди більша за Сv на величину універсальної газової сталої R.
З цього можна визначити фізичний зміст універсальної газової сталої R. Вона чисельно дорівнює роботі ізобарного розширення одного моля ідеального газу при нагріванні його на 1°.
При розгляді термодинамічних процесів важливо знати характерне для кожного газу відношення Ср до Сv:
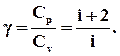 (2.46)
(2.46)
Згідно класичної теорії, теплоємність газів не залежить від температури проте дослід доводить, що це не так.
|

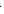
|
Рисунок 2.38.
На рисунку 2.38. показана експериментальна залежність Сv для водню. Вивчення цієї залежності показує, що в температурних інтервалах DТ1, DТ2, DТ3 теплоємність не залежить від температури, але в цілому збільшується з підвищенням температури. Такий хід залежності можна пояснити, відмовившись від закону про рівномірний розподіл енергії за ступенями свободи молекул. Можна припустити, що число ступенів свободи збільшується з підвищенням температури. При низьких температурах (DТ1) енергія розподіляється тільки між ступенями свободи поступального руху Сv=3R/2. При середніх температурах (DТ2) молекули починають обертатися Сv=5R/2. При подальшому підвищенні температури "збуджуються" і ступені свободи коливального руху. При високих температурах (DТ3) Сv=7R/2. Неточність закону про рівномірний розподіл енергії по ступенях свободи молекул пояснюється тим, що рух молекул не підпорядковується законам класичної механіки і класичної статистики. Залежність Сv від Т пояснює квантова теорія теплоємкостей.
Дата добавления: 2020-10-25; просмотров: 1221;











