Перший закон термодинаміки
Термодинаміка - це наука про теплові явища. В протилежність молекулярно-кінетичній теорії, яка робить висновки на основі уявлень про молекулярну будову речовини, термодинаміка виходить з найбільш загальних закономірностей теплових процесів і властивостей макроскопічних систем. Висновки термодинаміки спираються на сукупність дослідних фактів і не залежать від наших знань про внутрішній устрій речовини, хоча у цілому ряді випадків термодинаміка використовує молекулярно-кінетичні моделі для ілюстрації своїх висновків.
Термодинаміка розглядає ізольовані системи тіл, що знаходяться в стані термодинамічної рівноваги. Це означає, що в таких системах припинилися усі спостережувані макроскопічні процеси. Важливою властивістю термодинамічно-рівноважної системи являється вирівнювання температури усіх її частин.
Якщо термодинамічна система була виведена із стану рівноваги зовнішніми діями, то зрештою вона перейде в інший рівноважний стан. Такий перехід називається термодинамічним процесом. Якщо процес протікає досить повільно (у межі нескінченно повільно), то система в кожен момент часу виявляється близькою до рівноважного стану. Процеси, що складаються з послідовності рівноважних станів, називаються квазістатичними.
Внутрішня енергія
Одним з найважливіших понять термодинаміки є внутрішня енергія тіла. Усі макроскопічні тіла мають енергію, яка знаходиться усередині самих тіл. З точки зору молекулярно-кінетичної теорії внутрішня енергія речовини складається з кінетичної енергії усіх атомів і молекул і потенціальної енергії їх взаємодії. Зокрема, внутрішня енергія ідеального газу дорівнює сумі кінетичних енергій усіх молекул газу, що знаходяться в безперервному і безладному тепловому русі. Внутрішня енергія ідеального газу залежить тільки від його температури і не залежить від об'єму.
Під числом ступенів свободи i розуміють число незалежних рухів (чи координат, які визначають положення частки в просторі). У одноатомних газів (аргон, гелій і так далі) кожна молекула може мати три незалежні рухи уздовж трьох взаємно перпендикулярних осей. Таким чином, одноатомна молекула має три ступені свободи (i=3). Молекула двоатомного газу (H2, N2, CO та ін.) має п'ять ступенів свободи (i=5), оскільки окрім трьох поступальних рухів вона може мати два обертальні рухи навколо двох взаємно перпендикулярних осей, що становлять прямий кут з лінією, що сполучає обидва атоми.
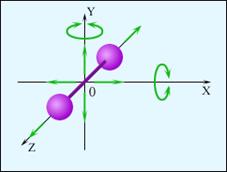
Рисунок 2.35.
На рисунку 2.35 зображена модель двоатомної молекули. Молекула може здійснювати п'ять незалежних рухів: три поступальних ходи уздовж осей X, Y, Z і два обертання відносно осей X і Y.
Молекули трьохатомного газу мають шість ступенів свободи (i=6): (3 поступальні і 3 обертальні). Ці ж шість ступенів свободи властиві кожній молекулі, що містить більше трьох атомів.
У класичній статистичній фізиці доводиться теорема про рівномірний розподіл енергії по ступенях свободи (закон Больцмана) :
Якщо система молекул знаходиться в тепловій рівновазі при температурі T, то середня кінетична енергія рівномірно розподілена між усіма ступенями свободи і для кожного ступеня свободи молекули вона рівна
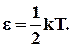 (2.28)
(2.28)
Тоді середня кінетична енергія однієї молекули рівна:
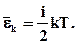 (2.29)
(2.29)
Оскільки молекула будь-якого газу має три поступальні ступені свободи середня поступальна енергія будь-якої молекули рівна:
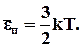 (2.30)
(2.30)
Цей результат ми знаходили виходячи з основного рівняння МКТ.
Отримаємо вираз для молекулярно-кінетичної або внутрішньої енергії газу :
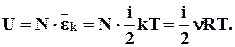 (2.31)
(2.31)
Таким чином, внутрішня енергія U тіла однозначно визначається макроскопічними параметрами, що характеризують стан тіла. Вона не залежить від того, яким чином було реалізовано цей стан. Прийнято говорити, що внутрішня енергія є функцією стану.
Дата добавления: 2020-10-25; просмотров: 540;











