Виды клинических исследований
В настоящее время клинические исследования подразделяются на: экспериментальное, когортные (проспективное, ретроспективное или историческое), опорное ,открытое, параллельное, перекрестное, пилотное, случай-контроль, плацебо-контролируемое, сравнительное, стратифицированное исследование, контролируемое, несравнительное, рандомизированное (см. глосарий).
Вместе с этим ,все клинические исследования классифицируются по определенным признакам: цели, продолжительности времени, по наличию вмешательства в обычную тактику ведения пациента и др.
Исследования по цели:
- профилактические исследования проводятся, чтобы найти наилучшие способы предупреждения заболеваний у людей, которые никогда ими не страдали, либо предупредить рецидив заболевания у пациентов;
- скрининговые исследования проводятся, чтобы найти наилучший способ выявления определённых заболеваний или состояний;
- диагностические исследования проводятся, чтобы найти наилучший способ диагностики определённого заболевания или состояния;
- терапевтические исследования проводятся, чтобы изучить эффективность и безопасность экспериментальных препаратов, новых комбинаций препаратов или новых методов в хирургии или лучевой терапии;
- исследования качества жизни проводятся, чтобы изучить способы повышения качества жизни пациентов, страдающих хроническими заболеваниями;
- программы расширенного доступа (по исключительным обстоятельствам предполагают использование экспериментального препарата у пациентов с серьёзными или угрожающими жизни заболеваниями, которые не могут быть включены в клиническое исследование, поскольку не соответствуют критериям включения.
Исследования по наличию вмешательства в обычную тактику ведения пациента (в стандартные процедуры обследования и лечения больного):
- обсервационное (наблюдательное) исследование - клиническое исследование, в котором исследователь собирает данные путём простого наблюдения событий в их естественном течении, не вмешиваясь в них активно;
- неинтервенционное исследование (“исследование без вмешательства”) - исследование, в котором лекарственное средство назначается обычным способом в соответствии с условиями, изложенными в разрешении на рыночную реализацию. Вопрос об “отнесении” пациента к конкретной стратегии лечения не решается заранее в протоколе исследования. Данный вопрос решается в соответствии с существующей практикой, и назначение препарата четко отделено от решения о включении пациента в исследование. Никакие другие процедуры диагностики или мониторинга для пациентов не применяются, а для анализа собранных данных используются эпидемиологические методы;
- интервенционное исследование - исследование новых, незарегистрированных лекарственных препаратов, иммунобиологических средств, медицинской техники либо исследование, в котором лекарственные препараты, иммунобиологические средства, медицинская техника назначаются или применяются способом, отличным от условий, изложенных в зарегистрированной инструкции.
Исследования по промежутку времени наблюдения:
- ретроспективное (историческое) исследование – исследование, при котором изучаются исходы проведенных ранее клинических испытаний или исследований, то есть исходы уже наступили дотого, как начато исследование. Исследователь просматривает медицинскую документацию и подбирает по определенным критериям пациентов с целью изучения результатов лечения.
- проспективное исследование- исследование, в котором пациенты набираются в соответствие с критериями, изложенными в протоколе исследования. Пациенты получают исследуемый препарат, и наблюдаться в течение какого-то времени. Формирование групп, получающих или не получающих исследуемое лекарственное средство, происходит до того, как фиксируются результаты. Большинство клинических исследований являются проспективными.
Исследования по длительности:
- одномоментное исследование -вариант описательного исследования, в котором рассматривается влияние факторов риска на популяцию и/или распространенность в ней заболевания (состояния) в определенный момент времени;
- продолжительные (продольные) - сбор данных несколько раз на протяжении длительного периода.
- лонгитудинальное исследование - продолжительное клиническое исследование, при котором ведется длительное периодическое наблюдение над одними и теми же лицами.
Исследования по месту проведения:
- международное исследование - исследование, которое проводится в нескольких странах;
- многоцентровое исследование -исследование, проводящееся в соответствии с единым протоколом в нескольких исследовательских центрах;
- метаанализ - данные разных экспериментов по одной теме обобщаются.
Исследования по степени случайности осуществления эксперимента:
- рандомизированные – когда после подписания согласия на эксперимент участники (ученые и исследуемые) тянут жребий - кому какой вид или часть эксперимента проводить. Некоторые исследователи предпочитают сначала распределить пациентов по группам с одинаковым прогнозом и только потом рандомизировать отдельно каждую группу (стратификационная рандомизация). Такую рандомизацию признают далеко не все.
- не рандомизированные. На данный момент серьезно в научном мире не воспринимаются. Участники могут сознательно или несознательно сговориться и саботировать результаты.
Исследования по информированности участников о течении процесса исследования:
Слепое или замаскированное исследование- исследование, когда отсутствует информация о том, к какой группе – экспериментальной или контрольной отнесен каждый испытуемый. Существует несколько вариантов таких исследований:
- простое слепое исследование – информация отсутствует только у пациента;
- двойное слепое исследование – информация отсутствует и у пациента, и исследователя;
- тройное или абсолютное слепое исследование – информация отсутствует у пациента, исследователя и лиц, проводящих статистическую обработку результатов исследования.
Замаскированные исследования применяются для устранения систематических ошибок в клинических исследованиях.
Исследования по эффективности полученных результатов:
- прямые - точно приводят к улучшению жизни пациента. К прямым критериям эффективности относят выздоровление, снижение летальности и осложнений, сокращение срока госпитализации, улучшение качества жизни;
- косвенные (суррогатные) - приводят к нормализации какого-нибудь медицинского показателя (например – артериального давления), который, теоретически, должен улучшать жизнь пациента. На практике же оказывается, что нормализация показателя может на выздоровление никак не влиять или даже ухудшать прогноз. Это не означает, что к косвеным результатам не надо относиться всерьез. Если нет данных о прямых исследованиях, то руководствоваться косвенными на практике можно, но осторожно.
Все исследования делятся на три класса.
I классу исследований относится “Золотой стандарт” - рандомизированные контролируемые (проспективные) испытания с двойным или тройным “слепым” контролем. Материалы этих испытаний и проведенный на их основе мета-анализ должны использоваться в медицинской практике в качестве источника наиболее достоверной информации.
К II классу относятся хорошо спланированные открытые экспериментальные исследования, обсервационные проспективные и ретроспективные, которые при известной доле критичности результаты этих испытаний могут применяться в практике.
К III классу - исследования, в организации которых допущены значительные ошибки, описание случаев и серии случаев. Они, как и индивидуальный врачебный опыт, мнение экспертов или “авторитетов” рассматриваются как не имеющие достаточной научной основы.
4.2. Организация и планирование клинического исследования
Выбор темы исследования - крайне сложный творческий процесс, во многом обеспечивающий успех научной деятельности. Тема исследования должна быть актуальной, отличаться новизной, иметь научно-практическое значение. Поскольку выполнение научных исследований требует больших материально-технических и временных затрат, творческих усилий, выбор научной темы представляется важнейшим этапом научно-исследовательской работы. Выбор темы исследования целесообразно начинать с изучения опыта предшествующих поколений ученых. С этой целью необходимо изучить исследуемую проблему не только по источникам литературы, но и овладеть современной методической базой, знать, какие исследования проводятся в ведущих научных школах мира. Таким образом, на первом этапе планирования главное - исключить возможность дублирования и обеспечить достаточно высокий уровень собственных знаний по определенной проблеме. На втором этапе планирования следует найти оригинальный подход в постановке задачи исследования, а затем и в ее решении, используя новые методические подходы, области их использования и т.д.
В качестве приемов, позволяющих осуществлять поиск новых решений в научных исследованиях, можно использовать:
- ознакомление с текущей и ретроспективной информацией, преимущественно обзорно-аналитического характера;
- ознакомление с новейшими достижениями науки и техники в смежных областях знания и перенос в них методов и методических приемов из своей области знания или, наоборот, заимствование их из смежных областей;
- разработку новых, более совершенных методов исследования, технологий, приборов или композиционных материалов, открывающих широкие перспективы их использования в научных исследованиях;
- методы системного анализа, наукометрические методы и т. д.
При выборе темы научно-исследовательской работы необходимо руководствоваться следующими требованиями:
- новизна исследуемого вопроса и получаемых результатов;
- актуальностью;
- научно-практическая значимостью;
- доказательность выдвигаемых исследователем положений, вытекающих из полученных результатов.
План научно-исследовательской работы (может быть оформлен в виде договора между заказчиком и исполнителем) включает в себя обоснование, календарный план, калькуляцию стоимости, штатное расписание, отчет о проведенном патентно-информационном исследовании с заключением об исключении дублирования и целесообразности планирования научно-исследовательской работы.
Патентно-информационные исследования являются одним из основных разделов предплановых исследований и проводятся с целью определения научно-технического уровня и тенденций развития в планируемой области знания, патентоспособности предлагаемой к планированию научно-исследовательской работы и исключения дублирования. Патентно-информационные исследования осуществляются на основе анализа научно-медицинской информации. План, разработанный для любого исследования должен основываться на следующих свойствах (таблица 11).
Свойства плана исследования
Таблица 11
| Свойства | Характеристика свойства |
| Сравнение | - познавательная операция, лежащая в основе суждений о сходстве или различии объектов; с помощью С. выявляются количеств. и качеств. характеристики предметов, классифицируется, упорядочивается и оценивается содержание бытия и познания. |
| Рандомизация | - процедура отбора признаков для исследования (или получения сопоставимых групп в эксперименте ), когда каждый признак из некоторой совокупности и каждая комбинация признаков заданного размера имеет равные с другими шансы на попадание в выборку. |
| Репликация/Повторяемость | - проведение несколько испытаний для определения вариабельности данны |
| Однородность | - повторения измерений |
| Стратификация | - распределение экспериментальных единиц в относительно однородные группы (блоки, слои) с целью минимизации эффекта известных неслучайных источников вариабельности |
Контролируемые клинические испытания являются основным источником объективной информации для современной медицины - медицины, основанной на доказательствах, а их результатымогут быть промежуточными и окончательными, основными и дополнительными.
Для объективизации результатов проводят специальные контролируемые исследования с соблюдением ряда обязательных условий. Выделяют несколько типов таких исследований:
- сравнение с контролем;
- контролируемые клинические испытания;
- рандомизированные контролируемые исследования.
Исследования сравнения с контролем основаны на сопоставлении частоты тех или иных признаков в группе больных и группе здоровых либо в двух группах, в одной из которых пациенты подвергаются тому или иному воздействию (диета, тренировочные программы, лекарственные препараты и пр.), в другой нет. Такие исследования проводятся часто, но не являются контролируемыми.
В контролируемых клинических испытаниях для снижения влияния на результат субъективных факторов применяют метод ослепления. При проведении исследований слепым методом ни врач, ни пациент до его завершения не знают, когда используют изучаемый препарат, а когда его имитацию (плацебо).
4.3. Рабдомизация и контролируемые клинические исследования
Рандомизация - случайное отнесение людей к группам, например, для экспериментальных или контрольных схем лечения. В пределах случайной изменчивости рандомизация участников должна сделать контрольные и экспериментальные группы сходными в начале исследования и гарантировать, что личные суждения и предвзятость исследователя не влияют на отнесение к группам.
Рандомизированное контролируемое исследование - наиболее точный способ выявления причинно-следственных связей между лечением и исходом заболевания, а также определения экономической эффективности лечения.
Этот тип исследований имеет ряд особенностей:
- случайное распределение пациентов по сравниваемым группам;
- пациенты и исследователи до завершения работы не знают, какое именно лечение проводится в каждой из сравниваемых групп (хотя проведение таких двойных слепых исследований не всегда возможно);
- все группы, за исключением экспериментальных, получают идентичную терапию;
- анализ пациентов проводят в составе групп, в которые они были распределены;
- анализ сфокусирован на определении степени различий результатов между сравниваемыми группами.
Любая новая методика профилактики, диагностики, лечения позволяет лишь на несколько процентов повысить клинический эффект, что затрудняет объективное его выявление. В этих случаях, чтобы избежать ошибок, необходимо применять тонкие и чувствительные – контролируемые методы исследования, где сопоставляемые группы получают различные виды лечения: больные контрольной группы - стандартное (обычно лучшее по современным представлениям), а больные опытной группы - новое лечение.
Ведущими принципами надежности исследования являются:
- сопоставимость сравниваемых групп пациентов.
- однородность групп больных по всем признакам, которые влияют на исход заболевания.
- предварительная стратификация - распределение вариантов лечения осуществляется в однородных группах больных, сформированных по ведущим прогностическим признакам.
Истинная рандомизация предполагает обязательное соблюдение двух условий:
1 - непредсказуемый характер распределения больных на группы (исследователь не может предугадать, в какую группу попадет следующий больной),
2 - исследователь, проводящий набор больных, не должен знать, в какие группы попадают пациенты (“слепой отбор”).
Методы, при которых больных распределяют в порядке поступления то в опытную, то в контрольную группу, или отбирают по буквам алфавита, по нечетным и четным дням включения в исследование или дате рождения, не относятся к истинной рандомизации. При таком отборе врач заранее знает, какому методу лечения должен подвергнуться очередной больной и может предвзято включить его в “правильную” группу, т.е. чем меньше будут отличаться между собой больные в пределах такой группы и чем больше различия между группами при правильном выборе признака стратификации, тем надежнее результаты исследования.
Исследователь должен помнить, что несопоставимость групп наблюдения может возникнуть и после рандомизации, если не все больные будут в дальнейшем участвовать в исследовании, например из-за ошибок диагностики, побочных эффектов лечения, серьезных проявлений других заболеваний, отказа продолжать лечение или перехода в другую лечебную группу. Эти факторы способствует возникновению ошибок планирования, для предотвращения которых необходимо осуществлять их минимизацию с помощью проведения анализ в группах, исходя из допущения, что все больные получили лечение, предписанное при рандомизации). Такой “консервативный” подход уменьшает вероятность ложноположительного результата, т.е. выявления эффекта лечения, когда он на самом деле отсутствует. Кроме того, считается, что если более 80% из включенных больных наблюдались до конца исследования, его результаты могут быть достаточно надежными.
Статистическая оценка достоверной информации
Помимо ошибок связанных с планированием как мы установили в предыдущих разделах данного пособия возможно возникновение ошибок после процесса рандомизации в виде “смещений”/“систематических ошибок(bias)” и “случайностью, при водящих к отклонению результата в любую сторону от истинного, причем “смещение” и “случайность” взаимно не исключают друг друга.
Для исключения ошибок этого вида ошибок исследователи должны применять адекватные статистические методы анализа получаемых данных. Неправильная оценка статистической достоверности информации часто приводит к игнорированию клинически важных сведений и принятию во внимание клинически бесполезных данных.
В практической и научно-практической работе врачи обобщают результаты, полученные, как правило на выборочных совокупностях. Для более широкого распространения и применения полученных при изучении репрезентативной выборочной совокупности данных и выводов надо уметь по части явления судить о явлении и его закономерностях в целом. Учитывая, что врачи, как правило, проводят исследования на выборочных совокупностях, теория статистики позволяет с помощью математического аппарата (формул) переносить данные с выборочного исследования на генеральную совокупность. При этом врач должен уметь не только воспользоваться математической формулой, но сделать вывод, соответствующий каждому способу оценки достоверности полученных данных. С этой целью врач должен знать способы оценки достоверности.
Применяя метод оценки достоверности результатов исследования для изучения общественного здоровья и деятельности учреждений здравоохранения, а также в своей научной деятельности, исследователь должен уметь правильно выбрать способ данного метода. Среди методов оценки достоверности различают параметрические и непараметрические.
Параметрическими называют количественные методы статистической обработки данных, применение которых требует обязательного знания закона распределения изучаемых признаков в совокупности и вычисления их основных параметров.
Непараметрическими являются количественные методы статистической обработки данных, применение которых не требует знания закона распределения изучаемых признаков в совокупности и вычисления их основных параметров. Как при параметрических, так и непараметрических методах для сравнения выборочных совокупностей в статистической процедуре оценки основное значение имеет полученный критерий достоверности.
Суть параметрического метода заключается в определении ошибки репрезентативности, т.е. погрешность, обусловленной переносом результатов выборочного исследования на всю генеральную совокупность. Погрешность исследования измеряется следующими математическими методами (схема 5).
Методы параметрического определения погрешности
Схема 5
| Средняя ошибка средней арифметической величины = | 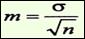
| где σ - среднеквадратическое отклонение; n - число наблюдений |
| Ошибка относительного показателя | 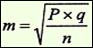
| где: p - показатель, выраженный в %, ‰, %оо и т.д.; q = (100 - р), при p выраженном в %; или (1000 - р), при p выраженном в ‰ или (10000 - р), при p выраженном в %оо и т.д. |
| При числе наблюдений меньше 30 ошибки репрезентативности определяются соответственно по формулам: | 
|
Определение доверительных границ средних и относительных величин осуществляется по формуле (схема 6):
Схема 6
| Для средних величин (М) | Мген = Мвыб ± tm; | где, Мген и Рген - соответственно, значения средней величины и относительного показателя генеральной совокупности; Мвы6 и Рвы6 - значения средней величины и относительного показателя выборочной совокупности; - m - ошибка репрезентативности; - t - критерий достоверности (доверительный коэффициент) |
| Для относительных показателей (Р) | Рген = Рвыб ± tm, |
Данный способ применяется в тех случаях, когда по результатам выборочной совокупности необходимо судить о размерах изучаемого явления (или признака) в генеральной совокупности. Обязательным условием для применения способа является репрезентативность выборочной совокупности. Для переноса результатов, полученных при выборочных исследованиях, на генеральную совокупность необходима степень вероятности безошибочного прогноза (Р), показывающая, в каком проценте случаев результаты выборочных исследований по изучаемому признаку (явлению) будут иметь место в генеральной совокупности. При определении доверительных границ средней величины или относительного показателя генеральной совокупности, исследователь сам задает определенную (необходимую) степень вероятности безошибочного прогноза (Р).
Для большинства медико-биологических исследований считается достаточной степень вероятности безошибочного прогноза, равная 95%, а число случаев генеральной совокупности, в котором могут наблюдаться отклонения от закономерностей, установленных при выборочном исследовании, не будут превышать 5%. Заданной степени вероятности (Р) безошибочного прогноза соответствует определенное, подставляемое в формулу, значение критерия t, зависящее также и от числа наблюдений. При n>30 степени вероятности безошибочного прогноза Р = 99,7% - соответствует значение t = 3, а при Р = 95,5% - значение t = 2. При п<30 величина t при соответствующей степени вероятности безошибочного прогноза определяется по специальной таблице (Н.А. Плохинского).
Оценка достоверности разности результатов исследования (схема 7) применяется в тех случаях, когда необходимо определить, случайны или достоверны (существенны), т.е. обусловлены какой-то причиной, различия между двумя средними величинами или относительными показателями. Обязательным условием для применения данного способа является репрезентативность выборочных совокупностей, а также наличие причинно-следственной связи между сравниваемыми величинами (показателями) и факторами, влияющими на них.
Формулы определения достоверности разности
Схема 7
| для средних величин | 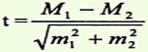
|
| для относительных величин | 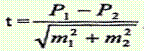
|
| где: t - критерий достоверности; m1 и m2 - ошибки репрезентативности; М1 и М2 - средние величины; Р1 и Р2 - относительные показатели. |
Если вычисленный критерий t более или равен 2 (t ≥ 2), что соответствует вероятности безошибочного прогноза Р равном или более 95% (Р ≥ 95%), то разность следует считать достоверной (существенной), т.е. обусловленной влиянием какого-то фактора, что будет иметь место и в генеральной совокупности.
При t < 2, вероятность безошибочного прогноза Р < 95%, это означает, что разность недостоверна, случайна, т.е. не обусловлена какой-то закономерностью (не обусловлена влиянием какого-то фактора). Поэтому полученный критерий должен всегда оцениваться по отношению к конкретной цели исследования.
При применении способа оценки достоверности разности результатов исследования могут допускаться типичные ошибки:
- при оценке достоверности разности результатов исследования по критерию t часто делается вывод о достоверности (или недостоверности) самих результатов исследования. В действительности же этот способ позволяет судить только о достоверности (существенности) или случайности различий между результатами исследования;
- при полученном значении критерия t<2 часто делается вывод о необходимости увеличения числа наблюдений. Если же выборочные совокупности репрезентативны, то нельзя делать вывод о необходимости увеличения числа наблюдений, т.к. в данном случае значение критерия t<2 свидетельствует о случайности, недостоверности различия между двумя сравниваемыми результатами исследования.
Возможности дизайна и структуры клинических испытаний. Варианты структуры исследования.
Врачебное искусство складывается из: объема знаний, необходимых для понимания причин и патофизиологических механизмов заболеваний, из клинического опыта, интуиции и набора качеств, которые в совокупности составляют так называемое “клиническое мышление”.
Для достижения требуемых результатов клиническое мышление должно опираться на определенные требования, в частности по отношению к дизайну исследований и испытаний.
При планировании клинических испытаний в зависимости от конкретных условий и целей может быть выбран различный порядок их проведения или дизайн. Для каждого дизайна исследования сегодня сформировались определенные требования к его подготовке, специфические стандарты качества проведения, обработки и представления данных. Чаще всего применяют три варианта дизайна испытаний:
- клиническое исследование в одной группе;
- клиническое исследование в параллельных группах;
- клиническое исследование в “перекрестной модели”.
При проведении клинического исследования в одной группе для всех пациентов используется один и тот же терапевтический режим, при этом на основании полученных результатов возможны лишь наблюдение и оценка динамики заболевания, но не принятие решения о наличии, отсутствии или величине конечного эффекта лечения. Главным недостатком модели исследований в одной группе является отсутствие группы сравнения.
Клиническое исследование в параллельных группах наиболее приемлемый и удобный в практическом отношении дизайн для демонстрации эффекта лечения, так как здесь действуют минимальные ограничения по основной патологии и меньше проблем, связанных с организацией. В этом случае каждый пациент попадает под одну из схем лечения, проходящих испытания. Каждой схеме лечения соответствует своя терапевтическая группа, и все пациенты, отнесенные к той или иной терапевтической группе, получают одинаковое лечение. Несмотря на то, что клинические исследования в дизайне параллельных групп дорогостоящие, продолжительные и требуют большого количества испытуемых, они применяются широко, поскольку являются наиболее объективными в определении эффективности лечения и точными в формулировании выводов.
Клиническое исследование в “перекрестной модели” позволяет оценить эффекты, как изучаемых лекарственных препаратов, так и сравнительных курсов лечения на одних и тех же испытуемых. Для этого их рандомизируют в группы, в которых проводят одинаковое курсовое лечение, но с различной последовательностью. Такой подход обеспечивает более надежное тестирование терапевтического эффекта при меньшей численности пациентов, чем схема параллельного группового анализа. Перекрестные варианты дизайна часто находят свое место при проведении клинико-фармакологических испытаний. В целом они в наибольшей степени удовлетворяют задачам анализа эффективности различных комбинаций активных компонентов в испытаниях на здоровых добровольцах.
При планировании клинического исследования важно определить показатели, которые позволят оценить полученный эффект. С позиции эффекта выделяют показатели процесса и показатели результата.
Показатели процесса – это всевозможные измерения биохимических, физиологических и прочих параметров, которые как полагает исследователь, играют положительную или отрицательную роль.
Показатели результата – это данные, обладающие реальной клинической значимостью. Так, при диабете лечение не может быть оценено по стойкости и величине гипогликемического эффекта; нужно знать, как оно влияет на уровень смертности.
Оптимальной формой изучения эффекта лечения служат рандомизированные контролируемые исследования с двойным слепым контролем. Ценность доказательств последовательно снижается в ряду от рандомизированных контролируемых исследований, включающих достаточное количество больных, до описания ограниченного числа больных или отдельных больных без контрольной группы.
Дата добавления: 2020-10-25; просмотров: 836;











