Поверхностное натяжение веществ на границе с воздухом
(Т=298 К)
| Жидкость | σ 103, Дж/м2 | Твердое вещество | σ 103, Дж/м2 |
| Н2О | 71,95 | Н2О (лед при 270 К) | 120,0 |
| С6Н6 | 28,2 | Кварц. стекло | |
| ССl4 | 25,02 | Al | |
| C2H5OH | 22,10 | Fe | |
| C3H8O3 глицерин | 59,4 | С (алмаз), грань (111) | |
| Hg | 473,5 |
У твердых тел межмолекулярные и межатомные взаимодействия больше на величину, определяющую ∆Нпл . Соответственно, они имеют большие значения σ или Gs. Для более тугоплавких веществ значения σ выше, что объясняется более прочными межмолекулярными связями.
3) природа контактирующих фаз
Чем сильнее взаимодействие между контактирующими фазами, тем меньше поверхностное натяжение на границе раздела этих фаз.
В случае контакта двух несмешивающихся жидкостей ж1/ж2 нельзя пренебречь взаимодействием между молекулами на границе раздела фаз.
Наличие над слоем одной жидкости другой, несмешивающейся с первой, приводит к уменьшению σ, поскольку при взаимодействии между контактирующими фазами уменьшается нескомпенсированность сил на поверхности первой жидкости.
Поверхностное натяжение уменьшается тем сильнее, чем меньше различие в полярностях на границе раздела ж1/ж2. Жидкости, близкие по полярности, смешиваются друг с другом, и поэтому их σ1,2 может быть равным 0. Чем больше разность полярностей фаз, тем выше поверхностное натяжение на границе раздела фаз.
Приведем примеры (при Т=293 К):
σН2О/г = 72,75 мДж/м2
σН2О/С6Н6 = 34,11 мДж/м2
σН2О/СН3Сl = 27,7 мДж/м2
σН2О/эт.эфир = 10,0 мДж/м2
σН2О/С2Н5ОН= 0 мДж/м2, так как границы раздела между спиртом и водой не существует.
Если жидкости мало растворимы друг в друге, то как показал Антонов еще в 1908 г. σ на границе ж1/ж2 ≈ разности поверхностных натяжений взаимно насыщенных жидкостей на границе их с воздухом (правило Антонова):σ ж1/ж2 ≈ σ ж1/в - σ ж2/в (2.19)
Влияние добавок
Поверхностное натяжение растворов отличается от поверхностного натяжения растворителя. Зависимость σж/г = f(С) при Т=const называется изотермой поверхностного натяжения. Знак dσ/dс указывает на характер зависимости σ от концентрации С. Условимся рассматривать изотерму поверхностного натяжения только для водных растворов, поэтому при С=0 поверхностное натяжение σо равно σн2о при данной температуре.
σ
1
с
Рис.2.6. Изотермы поверхностного натяжения на границе ж/г в зависимости от концентрации растворенного вещества
Для водных растворов различают 3 основных типов изотерм:
1. поверхностно-неактивные вещества, не изменяющие поверхностное натяжение (кривая 1).
2. поверхностно- инактивные вещества (электролиты), которые в воде диссоциируют с образованием ионов, которые хорошо гидратируются, т.к. Еион/н2о>Е н2о/н2о, поэтому ионы интенсивно втягиваются вглубь раствора, dσ/dс > 0 (кривая 2).
Для границы раздела фаз вода - воздух это соли, щелочи, минеральные кислоты, т.е. любые соединения, образующие в растворе только неорганические ионы. Их действие объясняется следующим образом: силы притяжения ионов и диполей воды сильнее, чем диполей друг к другу, поэтому при растворении ПИВ в воде увеличиваются межмолекулярные взаимодействия в поверхностном слое, а, следовательно, увеличивается и σ.
Эффект увеличения σ от добавки ПИВ в воду обычно незначителен. Это видно из рис.2.5. Так, поверхностное натяжение чистой воды при 20°С равно 72,8 мДж/м2, для 1 % раствора NaOH оно составляет 73,0 мДж/м2 и лишь у 10% раствора NaOH ст достигает 77,5 мДж/м2.
3. поверхностно-активные вещества, которые уменьшают поверхностное натяжение на границе раздела фаз (кривая 3).
Способность уменьшать поверхностное натяжение называется поверхностной активностью 
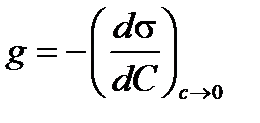 (2.20)
(2.20)
К ПАВ относятся органические молекулы с несимметричным строением молекул, состоящие из полярных и неполярных групп – с дифильным строением (рис.2.7):
полярная группа : -СООН; - -NO2; -СHO; - ОН; -NH2;SO2OH
неполярный углеводород-
ный радикал
Рис. 2.7. Условное изображение молекулы ПАВ
Полярные группы в воде гидратируются, неполярная часть молекул ПАВ представляют собой гидрофобную углеводородную цепь или радикал.
Молекула ПАВ из-за своего дифильного строения по-разному взаимодействует с молекулами воды в растворе: полярная часть легко гидратируется (благодаря этому идет растворение молекул ПАВ – этот процесс энергетически очень выгоден), неполярный углеводородный радикал, слабо взаимодействуя с водой, препятствует межмолекулярному взаимодействию диполей воды друг с другом.
Ен2о/н2о > Ен2о/ПАВ (напоминаем, что взаимодействие молекул воды друг с другом достаточно сильное – ориентационное, индукционное, дисперсионное, плюс водородные связи), поэтому энергетически выгоднее удалить неполярные длинные углеводородные радикалы из объема.
В результате на поверхности образуется определённым образом ориентированный адсорбционный слой, в котором полярная часть обращена в воду, а неполярный радикал - в контактирующую фазу (например, в воздух). При этом уменьшается избыточная поверхностная энергия, а, следовательно, и поверхностное натяжение.
Кривая 3 на рис. 2.6. характеризует зависимость σ=f(С) для водных растворов полярных органических веществ с не очень длинными цепями и недиссоциирующими или слабодиссоциирующими группами алифатических спиртов, аминов, жирных кислот. Для них поверхностное натяжение падает сначала линейно, затем по логарифмическому закону.
Этот тип зависимости σ=f(С) хорошо описывается эмпирическим уравнением Шишковского: σ= σо – В ln(1+A С). (2.21)
Физический смысл коэффициентов А и В мы обсудим несколько позже.
(Значение константы А возрастает в 3-3,5 раза при переходе к гомологу, а В = RTГ∞, где Г∞ — предельная адсорбция)
Обычно не даю, чтобы не путать:
Существует большая группа ПАВ с большим гидрофобным радикалом и сильно гидратирующейся полярной группой. В растворах таких соединений с увеличением концентрации до некоторой критической величины – ККМ (критической концентрации мицеллообразования) образуются мицеллы – агрегаты из ориентированных молекул ПАВ. Поверхностное натяжение таких растворов определяется индивидуальными молекулами ПАВ, т.к. мицеллы почти не снижают поверхностное натяжение раствора – кривая 4.
Дата добавления: 2016-07-27; просмотров: 5285;











