С увеличением температуры поверхностное натяжение всегда уменьшается.
Это связано:
а) с усилением теплового движения молекул, что ведёт к ослаблению межмолекулярного взаимодействия, уменьшения внутреннего давления и как следствие, уменьшению σ.
б) с другой стороны, увеличивается давление насыщенного пара Ро , что ведет к увеличению концентрации молекул в газовой фазе, к уменьшению нескомпенсированности сил на поверхности раздела фаз и уменьшению поверхностного натяжения.
Для большинства неполярных жидкостей эта зависимость линейна вплоть до Ткр (критической температуры – когда исчезает граница раздела фаз между жидкостью и паром - см. критические параметры в справочнике, например, для Н2О: Ткр=373,9о С, Р= 217,7 атм; для С2Н5ОН: Ткр= 243,1оС, Ркр=63 атм):
Из графика (рис. 2.5.) видно, что
σ dσ/dТ < 0 и постоянна, а, следовательно, определить поверхностное натяжение при любой температуре  можно по формуле:
можно по формуле: 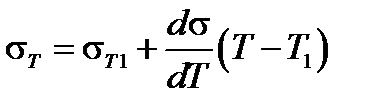 (2.18)
(2.18)
Ткр Т
Рис.2.5. Зависимость поверхностного натяжения неполярной жидкости от Т
Другие вещества менее строго следуют этой зависимости, но часто отклонениями можно пренебречь, т.к. dσ/dТ слабо зависит от температуры (для воды dσ/dТ= -0,16 10-3 Дж/м2).
2) природа фазы
Т.к. σ связано с работой, расходуемой на разрыв межмолекулярных связей, то оно ими и обусловлено.
Чем сильнее межмолекулярные связи в данной фазе, тем больше его поверхностное натяжение на границе с газовой фазой.
Поэтому σ у неполярных жидкостей ниже, чем у σ полярных. Большие значения поверхностного натяжения наблюдаются у веществ с водородными связями, например, Н2О.
Рассмотрим значения поверхностного натяжения некоторых веществ (табл. 2.2)
Таблица 2.2
Дата добавления: 2016-07-27; просмотров: 4063;











