Межмолекулярные связи
Межмолекулярное взаимодействие может иметь различный характер:
1. химические связи – образуются путем перекрывания электронных орбиталей и потому сугубо специфичны
2. водородные связи возникают между молекулами, содержащими функциональную группу – ОН: кислотами, щелочами, водой и др. веществ -
силикагель - Si – OH H
O O
- Si – OH H
3. Силы Ван-дер-Ваальса(*) (молекулярные связи), действующие между любыми молекулами.
Отличия молекулярных сил притяжения от химических:
а) по величине энергии: Емол= 5 - 50 кДж/моль
Е хим = 80 – 800 кДж/моль
б) молекулярные силы неспецифичны
в) различие по радиусу действия
r хим~ 10-8
r мол > 10-7 см
г) молекулярные силы аддитивны, а химические связи насыщаемы
Молекулярные силы взаимодействия включают в себя:
а) ориентационные силы (Кеезома) (*)
Возникают между полярными молекулами в результате взаимодействия дипольных моментов. Из-за диполь-дипольного взаимодействия молекулы приобретают определенную ориентацию относительно друг друга
Энергия ориентационного взаимодействия сильно зависит от расстояния между молекулами:
Е μˉ1/ μˉ2 = - А1/r6 (2.1)
У полярной молекулы– центр тяжести «+» и «-» зарядов не совпадает (дипольный момент μˉi ≠ 0).
Степень полярности зависит от дипольного момента μˉi. Полярность многоатомных молекул определяется полярностями отдельных связей и их расположением относительно друг друга.
К неполярным неорганическим веществам относятся: элементы, симметрические молекулы газов, некоторые соли (сульфиды металлов).
При рассмотрении полярности или неполярности молекул органических следует обращать внимание не только на наличие полярной группы в молекуле, но и на расположение их в структурной формуле молекулы.
Например:
б) индукционные силы (силы Дебая(*)). Диполь у неполярной молекулы возникает в электрическом поле или под действием поля полярной молекулы.
Энергия связи зависит от поляризуемости молекул и также сильно уменьшается с увеличением расстояния:
Е инд = - А2/r6 (2.2)
в) дисперсионные силы (силы Лондона(*)) действуют между всеми молекулами. Возникают из-за непрерывного движения электронов в атомах, приводящего к образованию мгновенных диполей. В свою очередь электрическое поле мгновенного диполя одного атома индуцирует дипольный момент соседнего, что приводит к возникновению сил притяжения.
Е дисп = - А3/r6 (2.3)
 точнее
точнее 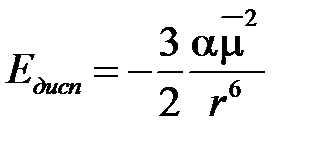 , (2.4)
, (2.4)
где α – поляризуемость молекулы.
Дисперсионные силы притяжения не зависят от температуры.
Молекулярные силы быстро убывают с увеличением расстояния между молекулами.
Рассмотрим соотношения между отдельными силами притяжения молекул (табл. 2.1):
Таблица 2.1
Дата добавления: 2016-07-27; просмотров: 2587;











