Суточная норма потребления ниацина в мг.
| Младенцы Дети Подростки Взрослые Беременные и кормящие Пожилые | 5–7 10–15 17–20 14–28 16–25 13–18 |
Обеспеченность организма витамином РР оценивается по величине экскреции с мочой N¢-метилникотинамида, которая в норме составляет 0,4–0,5 мг/час.
Гиповитаминоз. Недостаточность витамина РР приводит к заболеванию, называемому пеллагрой. Как правило, гиповитаминоз ниацина сопровождается гиповитаминозом и пиридоксина, поскольку для образования никотиновой кислоты из триптофана требуется кофермент этого витамина.
При пеллагре почти не изменяется скорость окислительных процессов. Очевидно, достаточно небольших количеств коферментов, чтобы сохранить интенсивность процессов окисления субстратов. Более вероятны нарушения других функций ниацина. В частности, НАД участвует в качестве субстрата в процессах репликации и репарации. Поэтому недостаток его сказывается на нормальном делении клеток быстро пролиферирующих тканей (кожа, слизистые и др.), возможно, с этим связаны некоторые симптомы пеллагры. Пеллагра проявляется в виде дерматита на участках кожи, доступных действию солнечных лучей, нарушением пищеварения - диареей, слабоумием и т. д. Болезнь Хартнупа (болезнь голубых пеленок) – следствие нарушения метаболизма триптофана – характеризуется появлением сыпи на коже, перемежающейся мозжечковой атаксией и умственной отсталостью.
Клиническое применение. Никотиновая кислота обладает не только антипеллагрическим свойствами, она улучшает углеводный обмен при легких формах диабета. Поскольку никотиновая кислота (но не ее амид) освобождает в тканях гистамин и активирует систему кининов, она улучшает микроциркуляцию в тканях, что используют при наличии сосудистых нарушений и гипоксии. У больных с гиперхолестеринемией никотиновая кислота уменьшает соотношение холесте-рин/фосфоли-пиды в липопротеинах низкой плотности. Ее назначают также при гастрите с пониженной кислотностью, заболеваниях печени (острых и хронических гепатитах), спазмах сосудов конечностей, почек, головного мозга, невритах лицевого нерва, атеросклерозе, длительно не заживающих язвах.
3.5 ПИРИДОКСИН (ВИТАМИН В6)
Строение. Термином витамин В6 обозначают производных триоксипиридина - пиридоксаль, пиридоксин, пиридоксамин, обладающие одинаковой витаминной активностью (рис. 3.11.). Белый мелкокристаллический порошок без запаха, горьковато-кислого вкуса. Легко растворим в воде, трудно – в спирте; рН 1 % водного раствора 2,5–3,5. Под влиянием света в водных растворах разрушается.

|
| пиридоксаль |
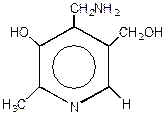
|
пиридоксамин

|
| пиридоксин |
Рис. 3.11. Структуры пиридоксаля, пиридоксамина, пиридоксина
Пищевые источники. Источником В6 для человека служат кишечные бактерии и пища. Богаты витамином В6 дрожжи, бананы, свежие овощи, рис и бобовые культуры, мясные продукты и рыба. В свежем коровьем молоке содержится около 60 мкг/100 ккал витамина В6. Этого количества может быть достаточно для обеспечения организма детей витамином, однако при кипячении или стоянии на солнце его содержание в молоке существенно снижается.
Метаболизм и функции. Всасывание витамина В6 происходит в тонком кишечнике путем диффузии. С кровью витамин В6 транспортируется к тканям, где, проникая в клетки, превращается в коферменты.
Синтез коферментов витамина В6 катализируется пиридоксалькиназой. Донором фосфатной группы в реакции фосфорилирования служит АТФ. Коферменты представляют собой фосфорилированные продукты пиридоксаля и пиридоксамина. Продуктом катаболизма является в основном 4-пиридоксиловая кислота, которая выделяется с мочой.
Пиридоксальфосфат принимает участие в основном в обмене аминокислот, в частности, он необходим для их переаминирования и декарбоксилирования. В основе взаимодействия пиридоксалевых ферментов и аминокислот лежит образование основания Шиффа. Реакции трансаминирования занимают важное положение в процессе катаболизма аминокислот и взаимосвязи аминокислотного и углеводного обменов. Аминотрансферазы иодтиронинов и иодтирозинов участвуют в биосинтезе иодсодержащих гормонов щитовидной железы и катаболизме их в периферических тканях.
Витамин В6, будучи структурным компонентом фермента цистатионсинтазы, катализирующей превращение гомоцистеина (продукт метаболизма метионина) в цистатион, участвует таким образом в утилизации свободного гомоцистеина. Гомоцистеин препятствует формированию коллагеновых микрофибрилл на стадии образования аллизина, необходимого для установления поперечных сшивок между молекулами коллагена. Повреждающее действие гомоцистеина на синтез микрофибрилл коллагена рассматривается как одно из звеньев в патогенезе атеросклероза. Указанная биохимическая функция определяет необходимость применения витамина В6 при терапевтическом назначении метионина.
Пиридоксалевые ферменты катализируют реакции декарбок-силирования аминокислот, в результате которых образуются биогенные амины. Пиридоксалевые ферменты участвуют также в процессах обезвреживания биогенных аминов, в частности, аминотрансфераза γ-аминобутирата и диаминооксидаза, обслуживающая один из путей катаболизма гистамина.
Пиридоксальфосфат является также коферментом кинурениназы, участвующей в гидролитическом расщеплении кинуренина и 3-оксикинуренина. Нарушение кинурениновой реакции при недостаточности витамина В6 приводит к снижению скорости образования никотиновой кислоты из триптофана.
Пиридоксальзависимый фермент синтетаза δ-аминолевулиновой кислоты катализирует взаимодействие глицина и сукцинил-КоА - ключевую реакцию в биосинтезе гема. По-видимому, нарушение этой реакции можно рассматривать как одну из причин развития анемии при гиповитаминозе В6.
Гликогенфосфорилаза, катализирующая фосфоролитическое расщепление гликозидных связей в молекуле гликогена, также является придоксальзависимым ферментом.
Суточная норма потребления витамина В6 в мг.
| Младенцы Дети Подростки Взрослые Беременные и кормящие Пожилые | 0,4–0,6 0,9–1,6 1,6–2,0 1,8–2,0 2,1–2,3 2,0–2,2 |
Об обеспеченностивитамином В6 судят по одному из двух показателей: величине ПАЛФ-эффекта, т. е. коэффициента активации пиридоксальзависимой аспартатамино-трансферазы эритроцитов при добавлении in vitro экзогенного пиридоксальфосфата (ПАЛФ), и концентрации ПАЛФ в плазме, определяемой методом высокоэффективной жидкостной хроматографии. В качестве критериев адекватной обеспеченности витамином В6 приняты величина ПАЛФ-эффекта ниже 2,0 или концентрация ПАЛФ в плазме крови равная или выше 8,2 нг/мл. В качестве критериев выраженного дефицита витамина В6 приняты показатели концентрации ПАЛФ ниже 4 нг/мл и величины ПАЛФ-эффекта выше 4,0. Обеспеченность организма витамином В6 оценивается по величине экскреции с мочой 4-пиридоксиловой кислоты, которая в норме составляет 0,27–0,33 мкмоль/час.
Гиповитаминоз. Недостаточность пиридоксина описана у детей. Она сопровождается повышенной возбудимостью ЦНС и периодическими судорогами, что связано с недостаточным образованием ГАМК, являющейся тормозным медиатором нейронов мозга. Признаками гиповитаминоза у детей являются также гипотрофия, шелушение кожи, гипохромная микроцитарная анемия, диарея, рвота. У взрослых недостаточность наблюдается при длительном лечении противотуберкулезным препаратом изониазидом, который является антагонистом пиридоксаля.
Клиническое применение. Кроме лечения гиповитаминоза, В6 пиридоксин применяют при токсикозах беременных, у которых он проявляется неукротимой рвотой, сидеробластной анемии, лейкопениях различной этиологии, заболеваниях нервной системы (паркинсонизм, малая хорея, невриты, невралгии), а также морской и воздушной болезни. В дерматологической практике пиридоксин применяют при себорееподобных и несеборейных дерматитах, опоясывающем лишае, псориазе, экссудативных диатезах. Имеются данные о том, что пиридоксин увеличивает диурез и усиливает действие диуретиков. Пиридоксин рекомендуют включать в терапию гипотрофий недоношенных детей с низкой массой тела при рождении, новорожденных с анемиями, судорогами неясной этиологии, при недостаточной функции печени, слабости сердечных сокращений.
3.6 ФОЛАЦИН (ВИТАМИН ВС), ФОЛИЕВАЯ КИСЛОТА
Строение. Фолиевая кислота состоит из трех структурных единиц: остатка птеридина (I), парааминобензойной (II) и глутаминовой (III) кислот.
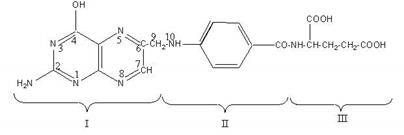
Рис. 3.12. Структура фолиевой кислоты
Фолиевая кислота представляет собой желтый мелкокристаллический порошок без запаха и вкуса. На свету разлагается.
Пищевые источники. Хорошими источниками витамина Вс являются свежие листовые овощи (салат, шпинат, капуста), помидоры, фрукты, злаковые и бобовые культуры, а также печень, мясо и дрожжи. В пищевых источниках витамин Вс может находится в виде свободных фолатов или полиглутаматов. В растениях фолиевая кислота содержит пептидную цепь из 7 остатков глутамата. В печени таких остатков в основном 5. Кишечная флора синтезирует фолиевую кислоту, причем более интенсивно при использовании растительной диеты. Тепловая обработка пищи обусловливает разрушение фолатов, которое может достигать 95 %. В женском молоке содержание фолиевой кислоты (в виде моноглутамата) колеблется в пределах от 50 до 140 мкг/л. Интересно, что назначение фолиевой кислоты женщинам в период лактации не приводит к увеличению витамина в молоке.
Метаболизм и функции. Поступающие с пищей полиглутаматы расщепляются под действием глутамилкарбоксипептидаз микробного происхождения до моноглутамильных фолатов, которые подвергаются всасыванию. Более эффективно всасываются восстановленные формы. Всасывание происходит быстро и в полном объеме в двенадцатиперстной кишке и проксимальном отделе тонкой кишки. Далее в клетках слизистой оболочки кишечника и в основном печени они восстанавливаются до тетрагидрофолиевой кислоты.
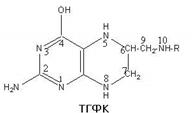 Восстановление происходит путем присоединения четырех атомов водорода в 5, 6, 7, и 8 положениях с образованием ТГФК. Образование ТГФК происходит через промежуточный продукт – дигидрофолиевую кислоту. Поэтому для восстановления фолиевой кислоты требуется последовательное участие фолятредуктазы и дигидрофолятредуктазы. Представляет интерес тот факт, что дигидрофолятредуктаза избирательно ингибируется антагонистами фолиевой кислоты: аминоптерином, аметоптерином и дихлораметоптерином. Поскольку дигидрофолятредуктаза участвует также в синтезе тимидилата, подавление ее функций антагонистами фолиевой кислоты ведет к блокированию образования ДНК и торможению роста клеток. Биологическая роль ТГФК определяется в основном наличием в положениях 5 и 10 активных в химическом отношении атомов азота, способных присоединять одноуглеродные радикалы.
Восстановление происходит путем присоединения четырех атомов водорода в 5, 6, 7, и 8 положениях с образованием ТГФК. Образование ТГФК происходит через промежуточный продукт – дигидрофолиевую кислоту. Поэтому для восстановления фолиевой кислоты требуется последовательное участие фолятредуктазы и дигидрофолятредуктазы. Представляет интерес тот факт, что дигидрофолятредуктаза избирательно ингибируется антагонистами фолиевой кислоты: аминоптерином, аметоптерином и дихлораметоптерином. Поскольку дигидрофолятредуктаза участвует также в синтезе тимидилата, подавление ее функций антагонистами фолиевой кислоты ведет к блокированию образования ДНК и торможению роста клеток. Биологическая роль ТГФК определяется в основном наличием в положениях 5 и 10 активных в химическом отношении атомов азота, способных присоединять одноуглеродные радикалы.
В печени аккумулируется 50–70 % общего содержания фолатов в организме. Запас фолатов в печени может в течение 3–5 месяцев препятствовать развитию анемии при недостаточном их поступлении с пищей.
В крови основная часть фолиевой кислоты содержится в эритроцитах (87 %). ТГФК участвует в реакциях переноса следующих одноуглеродных групп: метильная, метиленовая, метенильная, оксиметильная, формильная, формимино. Источником одноуглеродных фрагментов могут выступать серин, глицин, гистидин, холин, триптофан, метионин. Наибольшее значение в качестве источников одноуглеродных групп имеет серин, который, в свою очередь, может образовываться в необходимых количествах из глюкозы. Важной особенностью коферментов ТГФК является их способность к взаимопревращению. В частности, метил-ТГФК образуется в результате восстановления метилен-ТГФК под действием флавинзависимой метилен-ТГФК-редуктазы. Метил-ТГФК является непосредственным предшественником метильной группы метионина и составляет более 50 % фолатных соединений печени.
Коферментные формы ТГФК имеют важное значение в синтезе пуринов, так как они поставляют в состав пуриновых оснований формильную и метинильную группы. В синтезе тимина ТГФК поставляет метеленовую группу, которая является предшественником метильной группы тимидилата. И поэтому имеет чрезвычайное значение при клеточном восстановлении запасов тимина. Истощение запасов тимина ограничивает синтез ДНК. Важное значение метил-ТГФК имеет как донор метильных групп в реакциях ресинтеза метионина из гомоцистеина. Данная реакция является важной в связи с участием ее в процессе утилизации свободного гомоцистеина и тем самым ограничении его повреждающего действия на синтез коллагена. В этой реакции в качестве кофермента метилтрансферазы выступает кобаламин. Дефицит витамина В12 приводит к накоплению метил-ТГФК, что уменьшает количество ТГФК, способной связывать другие одноуглеродные фрагменты.
Фолиевые коферменты принимают участие также во взаимопревращениях серина и глицина. При ферментативном превращении гистидина в числе других промежуточных соединений образуется формиминоглутаминовая кислота (ФИГК). Для дальнейшего превращения ФИГК в глутаминовую кислоту необходимо присутствие фолиевого кофермента. Главное физиологическое значение превращения гистидина в глутаминовую кислоту, с точки зрения обмена фолатов, заключается в накоплении одноуглеродных единиц для образования метинил-ТГФК через стадию формимино-ТГФК.
Дата добавления: 2016-07-27; просмотров: 1726;











