НИАЦИН (ВИТАМИН РР, АНТИПЕЛЛАГРИЧЕСКИЙ)
Строение. Никотиновая кислота представляет собой соединение пиридинового ряда, содержащее карбоксильную группу.

Никотинамид отличается наличием амидной группы. Никотиновая кислота не гигроскопична, очень стойкая в сухом виде, растворы ее могут выдерживать автоклавирование в течение 20 мин без разрушения. Она переносит кипячение в 1н и 2н растворах минеральных кислот и щелочей.
Пищевые источники. Источником пищевого ниацина являются мясные продукты, особенно печень, кроме яиц и молока. Содержание ниацина в женском молоке – 0,29 мг/100 ккал, в коровьем молоке его значительно меньше – 0,12 мг/100 ккал. Из растительных продуктов хорошим источником витамина РР являются бобовые. В кукурузе и большинстве зерновых витамин РР содержится в связанном состоянии в форме эфира – ниацитина, который не усваивается организмом. Кроме того, кукурузный белок лишен триптофана, из которого в организме может синтезироваться НАД. Наибольшее количество никотиновой кислоты в зерновых продуктах обнаружено в оболочках, т. е. ее больше в отрубях. Никотиновая кислота – один из наиболее стойких витаминов при хранении, кулинарной обработке и консервировании. Обычные методы термической обработки приводят к потерям 15–20 % активности. Практически отсутствуют потери при замораживании. Витамин РР может синтезироваться в организме из триптофана, поэтому при достаточном поступлении в организм триптофана потребность в ниацине может снижена. Синтез витамина РР из триптофана происходит по кинурениновому пути. Процесс синтеза никотиновой кислоты из триптофана требует присутствия пиридоксаля, который является структурным компонентом кинурениназы, участвующей в гидролитическом расщеплении кинуренина и 3-оксикинуренина. Нарушение этой реакции при недостаточности витамина В6 уменьшает образование никотиновой кислоты из триптофана. Кроме того, гидроксикинуренин превращается в ксантуреновую кислоту. В норме этот метаболит отсутствует в моче, а при дефиците пиридоксаля он появляется. В никотиновую кислоту в среднем превращается 3,3 % триптофана. Из 60 молекул триптофана образуется одна молекула никотиновой кислоты. Поэтому 1 мг никотиновой кислоты или 60 мг триптофана было предложено называть «ниациновым эквивалентом».
Кроме того, возможен кишечный синтез никотиновой кислоты микроорганизмами.
Метаболизм и функции. Витамин РР входит в состав никотинамидадениндинуклеотида (НАД) (рис. 3.8) и никотинамидадениндинуклеотидфосфата (НАДФ) (рис. 3.9). По структуре оба кофермента – динуклеотиды, в которых мононуклеотиды соединены фосфодиэфирной связью. В состав одного из мононуклеотидов входит никотинамид, другой представлен адениловой кислотой. В НАДФ имеется дополнительный остаток фосфорной кислоты, соединенный с гидроксилом рибозы.
Ниацин, поступающий с пищей, всасывается в фундальной части желудка и в тонком кишечнике путем простой диффузии. С кровью он доставляется во все органы и ткани, где проникает внутрь клетки и участвует в синтезе НАД и НАДФ.
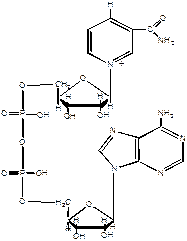
Рис. 3.8. Структура никотинамидадениндинуклеотида (НАД)
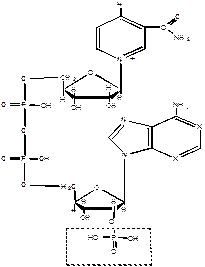
Рис. 3.9. Структура никонинамидадениндинуклеотидфосфата (НАДФ)
Биосинтез НАД из никотинамида происходит в две стадии:
а) Никотинамид + фосфорибозилпирофосфат ®
Никотинамид-мононуклеотид + РРii
б) Никотинамид-мононуклеотид + АТФ ® НАД+ + РРii
Первая стадия протекает в цитоплазме клеток, возможно, потому, что источником фосфорибозилпирофосфата для синтеза служит рибозо-5-фосфат пентозофосфатного цикла, локализованный в цитоплазме. Катализирует первую стадию никотинмононуклеотид-пирофосфорилаза. Вторая стадия катализируется НАД-пирофосфорилазой, находящейся в ядрах клеток. В митохондриях тоже имеются свои ферменты, участвующие в синтезе НАД.
НАДФ образуется из НАД с помощью НАД-киназы цитоплазмы по схеме:
НАД+ + АТФ ® НАДФ+ + АДФ
При распаде этих коферментов разрываются гликозидные связи с образованием никотинамида и рибозы. Никотинамид выводится с мочой главным образом в виде N'-метилникотинамида. Высокие нагрузки витамином РР могут приводить к обеднению организма метильными группами. При избыточном поступлении ниацина с мочой выводится свободная никотиновая.
Соотношение образующихся НАДФ и НАД явно в пользу НАД и колеблется от 1/3 в печени до 1/14 в сердечной мышце (эритроцит 1/12). В клетках больше окисленной формы НАД и больше восстановленной формы НАДФ.
Оба кофермента способны обратимо принимать электроны и протоны, поэтому они входят в состав дегидрогеназ. В реакциях, катализируемых никотинамидными ферментами, происходит отщепление двух атомов водорода от субстрата. Один атом водорода присоединяется к С4 никотинамидного кольца, а оставшийся свободный протон переходит в среду (рис. 3.10).
Функции выполняемые НАД и НАДФ можно разделить на три группы:
1) функция переносчиков водорода в ОВР,
2) функция субстратная для синтетических реакций,
3) регуляторная функция в качестве аллостерического эффектора.
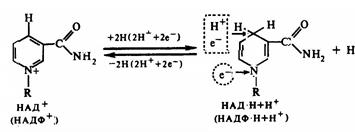
Рис 3.10. Участие НАД и НАДФ
в окислительно-восстановительных реакциях
Первая функция. НАД и НАДФ являются коферментами дегидрогеназ на начальных этапах окисления углеводов, жирных кислот, глицерина, аминокислот, на этапе превращения субстратов в ЦТК и терминальных стадиях дегидрирования в дыхательной цепи. Этим и объясняется исключительная роль этих коферментов в биоэнергетике и окислении веществ природного и чужеродного происхождения. Окислению в дыхательных цепях подвергается только НАДН.
НАДФН используется как донор водорода в реакциях синтеза жирных кислот, холестерина, желчных кислот, стероидных гормонов, восстановления окисленного глутатиона, дигидроксиацетонфосфата, метаболизма витаминов А, К, фолиевой кислоты.
Вторая функция коферментов витамина РР вытекает из участия НАД в качестве субстрата ДНК-лигазной реакции при репликации и репарации, следовательно, дефицит витамина РР в быстро регенирирующих тканях может сказаться на делении клеток и исправлении дефектов в цепи ДНК.
Третья, регуляторная функция состоит в том, что НАД и НАДФ являются аллостерическими эффекторами ряда ферментов энергетического обмена. Так, НАДН ингибирует активность изоцитратдегидрогеназы, декарбоксилирующей фосфопируваткарбоксикиназы, пируватдегидрогеназы. Избыток НАДФН вызывает ингибирование глюкозо-6-фосфатдегидрогеназы.
Дата добавления: 2016-07-27; просмотров: 2642;











