Раздел 1. Кинетическая модель обратимой реакции в общем виде
Рассмотрим обратимую гомогенную реакцию:
νАА + νВВ € νRR + νSS
Скорость изменения количества любого j–го компонента Wj, участвующего в обратимой реакции, выражается соотношением:
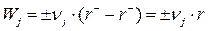
где νj – стехиометрический коэффициент при j–м компоненте («+» для продукта реакции, «–» для исходного вещества). Скорость обратимой реакции, определяемая по ЗДМ, равна разности скоростей прямой и обратимой реакций:
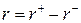
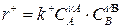 – скорость прямой реакции,
– скорость прямой реакции,
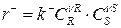 – скорость обратной реакции.
– скорость обратной реакции.
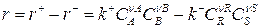
где E+, E– – энергия активации прямой и обратной реакций; k+, k– – константы скорости прямой и обратной реакций.
Тогда для обратимой реакции:
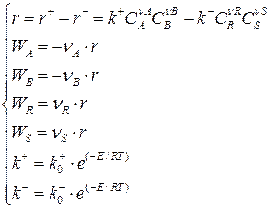 (3.1)
(3.1)
Уравнения (3.1) образуют систему уравнений кинетической модели обратимой реакции.
Решим эту систему для гомогенной обратимой реакции типа А € R.
Раздел 2. Кинетика обратимой реакции А € R
Зададимся начальными условиями:
T,V = const;
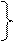 СА = САо при τ = 0
СА = САо при τ = 0
СR = СRо =0
Если V = const, то скорость реакции:
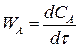 (3.2)
(3.2)
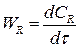 (3.3)
(3.3)
Составим кинетическую модель рассматриваемой реакции:
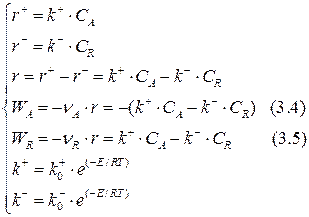
Сопоставим выражения (3.2) и (3.4), (3.3) и (3.5):
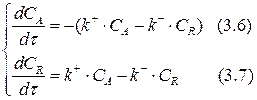
Определим изменение концентрации реагента А в ходе реакции.
Так как для нашей реакции νА= νR=1, то САо = СА + СR. Тогда СR = САо – СА. Подставим это выражение в уравнение (3.6):
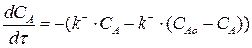
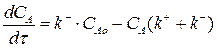 (3.7)
(3.7)
В состоянии равновесия 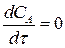 и тогда выражение (3.7) примет вид:
и тогда выражение (3.7) примет вид:
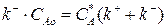 (3.8)
(3.8)
где С*А – равновесная концентрация реагента А. Она является постоянной величиной для данной реакции при заданной температуре и давлении.
Подставим выражение (3.8) в (3.7):
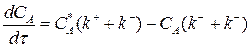
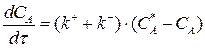
Разделим переменные, интегрируем от САо до СА и от 0 до τ :
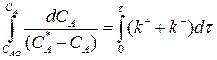
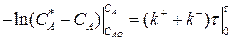
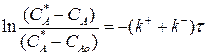
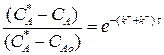
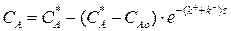 (3.9)
(3.9)
Выражение (3.9) представляет искомую зависимость СА = f(τ).
Изменение концентрации вещества R можно получить из уравнения материального баланса:
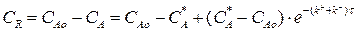 (3.10)
(3.10)
Выражение (3.9) представляет искомую зависимость СR = f(τ).
Получим зависимость степени превращения для данной обратимой реакции. Вспомним, что 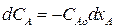 . Тогда:
. Тогда:
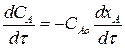 (3.11)
(3.11)
Кроме того,известно, что 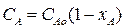 . Тогда из материального баланса:
. Тогда из материального баланса:
СR = САо – СА = САо – САо(1– xA) = САо xА (3.12)
Подставим выражения (3.11) и (3.12) в выражение (3.6):
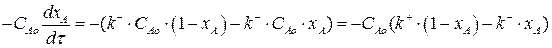
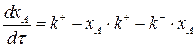
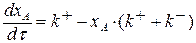 (3.13)
(3.13)
В состоянии равновесия 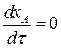 . Тогда выражение (3.13) примет вид:
. Тогда выражение (3.13) примет вид:
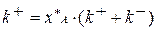 (3.14)
(3.14)
где хА* – равновесная степень превращения вещества А. Это величина постоянная для данной реакции при заданной температуре и давлении.
Подставим выражение (3.14) в (3.13)
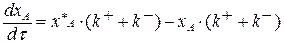
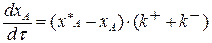
Разделим переменные, интегрируем от 0 до хА и от 0 до τ :
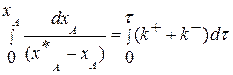
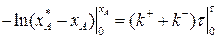
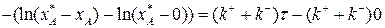
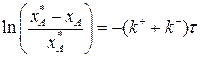
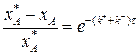
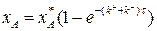 (3.15)
(3.15)
Выражение (3.15) представляет искомую зависимость xА = f(τ).
Изобразим графически зависимости СА, СR, хА = f(τ) для обратимой реакции.
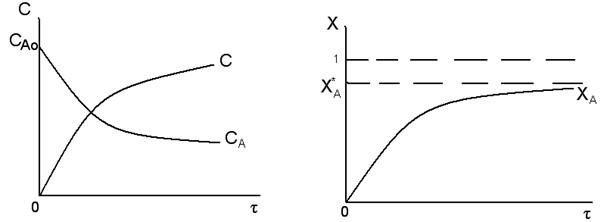 Из представленного следует, что для рассматриваемой обратимой реакции, концентрация реагента А уменьшается в ходе реакции по экспоненциальной зависимости. Но в отличие от необратимой реакции концентрация реагента с течением времени стремится не к нулю, а к некому равновесному значению СА*, которое отлично от нуля. Концентрация продукта R экспоненциально возрастает, но в отличие от необратимой реакции не достигает большого значения, а стремится к некому равновесному значению СR*. Степень превращения реагента экспоненциально возрастает и стремится, в отличие от необратимой реакции к некой равновесной степени превращения хА*, которая всегда меньше единицы.
Из представленного следует, что для рассматриваемой обратимой реакции, концентрация реагента А уменьшается в ходе реакции по экспоненциальной зависимости. Но в отличие от необратимой реакции концентрация реагента с течением времени стремится не к нулю, а к некому равновесному значению СА*, которое отлично от нуля. Концентрация продукта R экспоненциально возрастает, но в отличие от необратимой реакции не достигает большого значения, а стремится к некому равновесному значению СR*. Степень превращения реагента экспоненциально возрастает и стремится, в отличие от необратимой реакции к некой равновесной степени превращения хА*, которая всегда меньше единицы.
Дата добавления: 2020-10-14; просмотров: 543;











